熱門資訊> 正文
新股消息 | 丹諾醫藥遞表港交所 擁有利福特尼唑(TNP-2198)等三大核心產品
2025-07-31 06:46
智通財經APP獲悉,據港交所7月30日披露,丹諾醫藥(蘇州)股份有限公司(簡稱:丹諾醫藥)向港交所主板遞交上市申請,中信證券和農銀國際為聯席保薦人。

招股書顯示,丹諾醫藥於2013年註冊成立,是一家臨近商業化階段的生物科技公司,專注於發現、開發及商業化差異化的創新葯產品,以解決細菌感染及細菌代謝相關疾病領域的未被滿足臨牀需求。憑藉自主開發的多靶點偶聯分子技術,公司致力於為患者提供最佳治療方案,以克服傳統治療的侷限性並改善患者預后。截至最后實際可行日期,公司已建立一條由七項創新資產組成的差異化管線,包括三項核心產品:即利福特尼唑(TNP-2198),是全球首個且唯一治療幽門螺桿菌(「幽門螺桿菌」)感染的新分子實體(「NME」)候選藥物;利福喹酮(TNP-2092)注射劑,一款潛在首創三靶點治療植入體相關細菌感染的候選藥物;及TNP-2092口服制劑,全球首個用於治療腸道菌羣代謝相關疾病的多靶點候選藥物。
核心產品利福特尼唑(TNP-2198)是由利福黴素藥效團和硝基咪唑藥效團構建的穩定偶聯藥物。通過抑制RNA聚合酶和硝基還原酶激活產生高活性物質實現殺菌作用,對微需氧菌和厭氧菌具有協同雙重作用機制。利用這種獨特的多靶點機制,利福特尼唑有望克服抗菌藥物耐藥性這一重要且日益嚴重的全球挑戰。作為三聯療法的一部分,與目前指南推薦的一線治療方案鉍劑四聯療法(「BQT」)相比,利福特尼唑在療效、安全性、臨牀應用和患者潛在依從性方面具有顯著優勢。
丹諾醫藥已完成利福特尼唑三聯療法(「RTT」)對比BQT的中國III期頭對頭臨牀試驗,並計劃於2025年8月底前向國家藥品監督管理局(「國家藥監局」)提交新葯上市申請(「NDA」)。臨牀試驗結果表明,RTT在根除率、安全性及耐受性方面較BQT均有優勢。值得注意的是,在多重耐藥人羣中,RTT顯示出對BQT的優效性(89.9%vs.81.2%;差值:8.7%;非劣檢驗p<0.0001;優效檢驗p=0.023)。這項試驗的結果顯示,RTT組的臨牀相關TEAE發生率為37.3%,BQT組則為53.2%。大部分TEAE的嚴重程度為輕度至中度,且未報告與利福特尼唑相關的SAE。這些研究結果顯示,與BQT相比,RTT的安全性與耐受性較佳。此外,RTT無需提前進行藥敏試驗,這一特點凸顯其成為標準化一線療法的潛力,可實現與尿素呼氣試驗(「UBT」)的無縫銜接。此外,RTT給藥更為便捷,再加上更優的安全性和耐受性特徵,預計將顯著提高患者依從性。
丹諾醫藥正在為利福特尼唑實施明確的臨牀開發及商業化策略。通過與遠大生命科學簽訂的獨家商業合作協議,公司將藉助其強大的營銷能力和豐富的商業化資源,支持用於治療幽門螺桿菌感染的利福特尼唑在中國成功上市。憑藉美國食品藥物管理局(「FDA」)授予的IND許可、快速通道及合格抗感染產品(「QIDP」)認定,利福特尼唑可能受益於FDA的加速審評流程,有望加快在美國及其他海外市場的上市步伐。除幽門螺桿菌感染外,利福特尼唑在更廣泛的抗菌應用領域展現潛力。基於已獲得國家藥品監督管理局的IND批准,公司計劃推進利福特尼唑治療細菌性陰道病及艱難梭菌感染的臨牀開發。
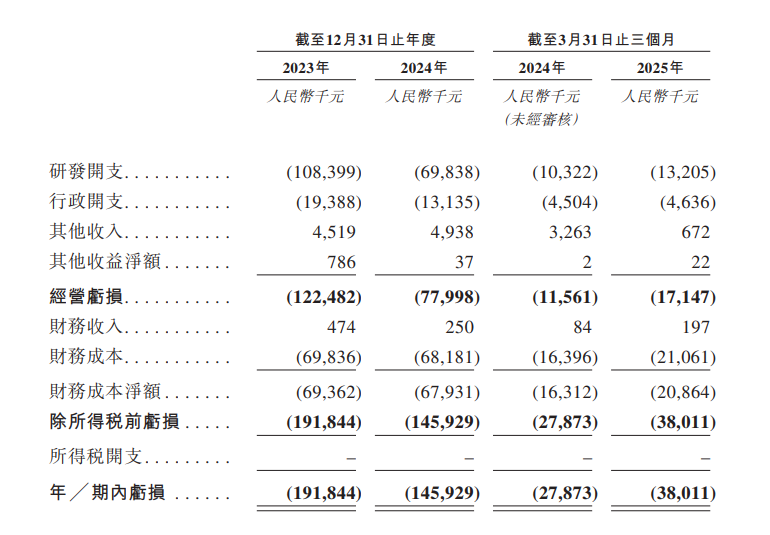
財務方面,於2023年度、2024年度、2024年以及2025年截至3月31日止三個月,丹諾醫藥經營虧損分別為約1.22億元、7799.8萬元、1156.1萬元、1714.7萬元人民幣;年/期內虧損分別為約1.92億元、約1.46億元、2787.3萬元、3801.1萬元人民幣。
推薦文章
美股機會日報 | 阿里發佈千問3.5!性能媲美Gemini 3;馬斯克稱Cybercab將於4月開始生產
港股周報 | 中國大模型「春節檔」打響!智譜周漲超138%;鉅虧超230億!美團周內重挫超10%
一周財經日曆 | 港美股迎「春節+總統日」雙假期!萬億零售巨頭沃爾瑪將發財報
一周IPO | 賺錢效應持續火熱!年內24只上市新股「0」破發;「圖模融合第一股」海致科技首日飆漲逾242%
從軟件到房地產,美國多板塊陷入AI恐慌拋售潮
Meta計劃為智能眼鏡添加人臉識別技術
危機四伏,市場卻似乎毫不在意
財報前瞻 | 英偉達Q4財報放榜在即!高盛、瑞銀預計將大超預期,兩大關鍵催化將帶來意外驚喜?

