熱門資訊> 正文
第二款「十億美元分子」獲BTD認證,和譽-B(02256)「真創新」配置價值凸顯
2025-05-28 09:46
5月26日,和譽-B(02256)正式宣佈依帕戈替尼(ABSK011)獲納入突破性治療品種,擬用於治療既往接受過免疫檢查點抑制劑(ICI)和多靶點酪氨酸激酶抑制劑(mTKI)治療失敗的FGF19過表達晚期肝細胞癌患者。
這也是繼匹米替尼(Pimicotinib/ABSK021)之后,和譽第二款獲納入突破性療法的重磅品種。
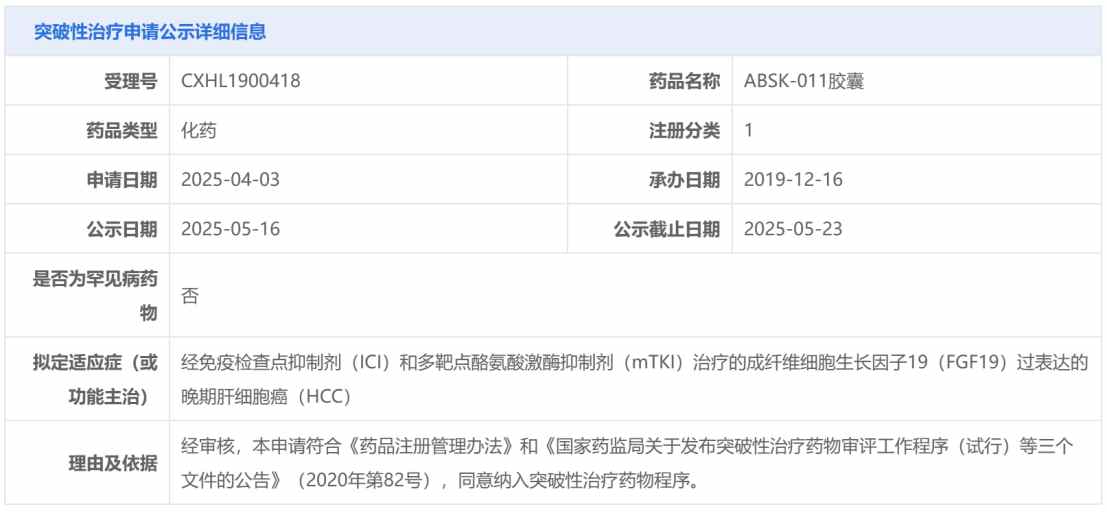
作為全球首個針對FGF19/FGFR4信號通路異常激活的小分子抑制劑,ABSK-011自2023年ESMO年會上首次亮相以來,便憑藉顯著的療效和相比其他FGFR4靶向藥更具依從性和經濟性優勢,廣受全球業界和市場關注。如今ABSK-011在國內順利獲納入突破性治療品種,也預示着其成為「超十億美元分子」的確定性正進一步提高,並存在潛在的重磅BD價值。
近日,正值三生製藥與輝瑞達成的一項總額高達60.5億美元的「出海」大單帶火了港股創新葯板塊,讓全球業界和市場目光聚焦於中國國產創新葯的同時,也讓投資者開始挖掘下一個具備重磅BD能力的稀缺標的,而手握兩款重磅BTD品種的和譽無疑值得高度關注。
「超十億美元分子」確定性進一步提高
近年來,和譽醫藥聚焦腫瘤精準治療與免疫治療,覆蓋EGFR、FGFR、CSF-1R,PMRT5等熱門靶點,已建立了19條具有全球競爭力的差異化創新研發管線,其中多款在研創新葯都具有「同類最優」或「全球首創」潛力。有望成為全球FGFR4抑制劑同類FIC藥物的依帕戈替尼(ABSK011)無疑是其中的佼佼者。
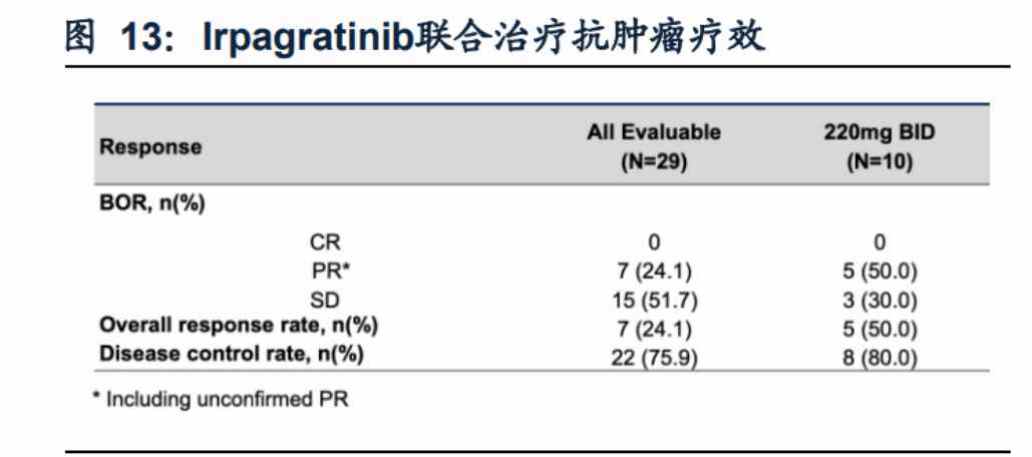
據智通財經APP瞭解,公司在去年ESMO年會上發佈了依帕戈替尼用於治療曾經過治療的aHCC患者的安全 性和有效性的最新I期臨牀數據。數據顯示,依帕戈替尼220mgBID組在經ICIs和mTKIs治療的FGF19過表達肝細胞癌患者中展現出優異的有效性,其ORR達到44.8%,mDOR為7.4個月,mPFS達到5.5個月,有效性表現在已遠超目前已上市及其他在研療法。
而在去年6月的2024 ESMO GI上,公司則發佈了該品種220mg BID與Atezolizumab聯用在治療1/2L患者中以50%的ORR數據,再度刷新針對經治肝細胞癌的在研新葯記錄。
特別值得注意的是,在之前接受過免疫檢查點抑制劑(ICI)治療的患者羣體中,和譽的此項聯合療法的療效同樣顯著且安全性良好,充分説明靶向FGF19-FGFR4這一新穎機制可能為肝癌帶來亟需的差異化治療手段,也進一步增強了依帕戈替尼聯用PD-L1衝擊一線治療的確定性。
市場之所以在ABSK011披露上述臨牀數據后對其保持持續高度關注,在於FGFR4這個靶點曾讓多家跨國藥企折戟沉沙。例如,諾華早期的候選藥物因嚴重骨骼毒性終止開發,Blueprint公司的BLU-554也因療效未達預期暫停臨牀。在高門檻研發環境下,當前全球尚無FGFR4抑制劑獲批上市。
而和譽醫藥能后來居上,關鍵在於分子設計上的創新與突破。據悉,和譽研發團隊通過上千次實驗篩選出高選擇性化合物,成功避免了脱靶FGFR1/2/3帶來的副作用。因此依帕戈替尼憑藉其在競爭格局中的領先地位,目前已實現「彎道超車」,有望成為首個治療FGF19過表達HCC患者的突破性藥物。
從市場角度來看,據GlobalData預測,到2029年,全球肝癌市場大約在53億美元左右,其中免疫療法約佔市場份額的72.2%,達到38億美元。參考此前已上市的小分子激酶抑制劑索拉非尼,其針對肝癌適應症的ORR不到20%,即便如此其在2021年全球銷售依然超過5億美元,側面反映出當前市場龐大的未滿足治療需求。
去年12月,CDE批准公司開展依帕戈替尼(ABSK011)用於HCC患者的註冊性臨牀研究。此次僅時隔不到半年ABSK011便獲納入CDE突破性品種,意味着依帕戈替尼的創新價值獲國內權威機構高度認可,后續有望憑藉優異的有效性及安全性逆襲為Global FIC/BIC,從而在海內外市場獲得更高的銷售上限,成為「超十億美元分子」確定性正進一步提高。
創新價值獲市場持續挖掘
在當前鼓勵和支持「原創新葯」的環境下,「真創新」毫無疑問是衡量國內創新葯企差異化創新能力的重要指標之一。
而突破性療法認證正是檢驗一款新葯真創新力的重要指標。據智通財經APP瞭解,BTD最初於2020年被CDE引入國內,其要旨集中於兩點:用於加快治療嚴重危及生命或嚴重影響生存質量的疾病新葯落地;針對適應症尚無有效治療手段或藥物,新葯較現階段治療手段具有足夠證明其臨牀優勢。簡言之,一款新葯想要獲得突破性療法,就一定要具備顯著的創新屬性和可靠的臨牀價值。
近年來,國內企業逐漸取代跨國製藥企業(MNC)成為CDE突破性療法新的主體,極大地提振了行業本土創新的信心。但從近年數據來看,突破性療法獲批主要集中在國內大型Biopharma,鮮有Biotech企業的重磅品種連續獲批。
以2024年為例,2024年CDE累計授予91款(公示日受理號計)藥物突破性療法,較2023年增長32%。獲受理號數量前30家企業中,國內創新葯企數量達到19家,共獲受理號52個,佔比達到57.14%。而在這19家國內創新葯企中,擁有2款及以上突破性療法藥物的Biotech企業不到5家。
由此側面印證了手握匹米替尼和依帕戈替尼兩款BTD重磅品種的和譽擁有顯著的創新價值和企業投資價值。
值得一提的是,與多數尚未盈利的Biotech企業不同,2024年和譽已首次實現全年度盈利,產生了豐富的現金流,並通過2024年報業績傳達出持續性規模化的盈利預期。在持續多年的高研發投入下,和譽創新管線內有多款優質管線處於早期臨牀和臨牀前階段;核心產品方面,匹米替尼、依帕戈替尼、ABSK043等核心管線的臨牀進展穩步推進,即將集中迎來商業化價值兑現期。
基於對自身「創新-盈利」正循環價值的認可,和譽管理層在近年來持續進行註銷式股票回購,用「真金白銀」回饋投資者的同時,向市場表達出對公司未來發展的強烈信心。今年3月3日,和譽董事會再次批准了公司動用2億港元在市場上購回股份。
智通財經APP數據顯示,今年年初至今,和譽管理層已累計回購28次,回購股數達789.50萬股,累計金額達到5932.68萬港元。
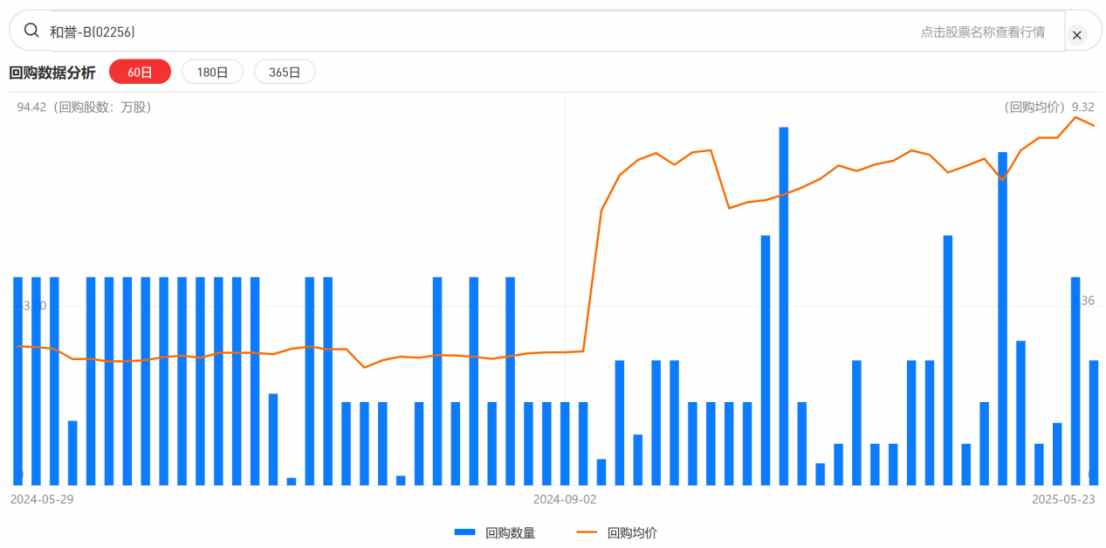
二級市場方面,雖然和譽股價近期受恆指大盤影響出現一定波動,但在4月9日觸底后,走出了一段持續反彈高走的行情。5月23日盤中股價最高觸及8.95港元,一個半月以來區間累計最大漲幅達到62.14%。
股價的快速反彈與持續高走,一方面説明和譽正經歷強勁的估值修復進程,另一方面也説明市場主力資金對基本面穩中向好、估值增長天花板更高的價值標的青睞有加。隨着醫藥板塊的估值修復行情逐漸展開,和譽有望成為后續投資者重要的資產配置標的。
推薦文章
美股機會日報 | 凌晨3點!美聯儲將公佈1月貨幣政策會議紀要,納指期貨漲近0.5%;13F大曝光!巴菲特連續三季減持蘋果
美股機會日報 | 阿里發佈千問3.5!性能媲美Gemini 3;馬斯克稱Cybercab將於4月開始生產
港股周報 | 中國大模型「春節檔」打響!智譜周漲超138%;鉅虧超230億!美團周內重挫超10%
一周財經日曆 | 港美股迎「春節+總統日」雙假期!萬億零售巨頭沃爾瑪將發財報
從軟件到房地產,美國多板塊陷入AI恐慌拋售潮
Meta計劃為智能眼鏡添加人臉識別技術
危機四伏,市場卻似乎毫不在意
財報前瞻 | 英偉達Q4財報放榜在即!高盛、瑞銀預計將大超預期,兩大關鍵催化將帶來意外驚喜?

