原創精選> 正文
藥聞頭條丨業績遠遜預期,Moderna一夜蒸發近250億美元!百濟Q3營收翻倍
2021-11-05 13:47
I Moderna一夜暴跌近18% Q3業績遠遜預期 意外下調預期銷量
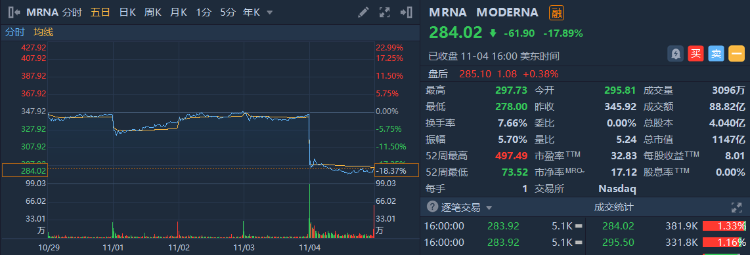
11月4日,Moderna發佈了2021財年三季度財報。
財報顯示,Moderna三季度營收49.7億美元,較去年同期、即歐美批准其新冠疫苗廣泛使用之前的1.58億美元大幅提升,但比市場預期的62.1億美元少了12.4億美元之巨。其主要產品mRNA新冠疫苗季度收入48.1億美元,環比增長15%,弱於市場預期的62.7億美元。
公司表示,由於生產和運輸問題,今年理應交付的一些新冠疫苗劑量被轉移到了2022年初,因此預計今年將提供7億至8億劑新冠疫苗,低於三個月前預期的8億至10億劑;預計今年的新冠疫苗銷售額為150億至180億美元,同樣低於此前預期的200億美元。
Moderna周四暴跌17.89%,收報284.02美元,當前市值為1147億美元,距離開盤時1396億美元跌近250億美元。
I 百濟神州公佈2021年Q3業績,產品收入同比增長111%
11月4日,百濟神州公佈其近期業務亮點、預計里程碑事件以及2021年第三季度及2021年前九個月(截至9月30日)的財務業績,要點如下:
- 2021年第三季度產品收入共計1.925億美元,相較去年同期9110萬美元增長111%;
- 百悦澤在美國獲批兩項新適應症,並在其他六個國家和地區獲批上市
- 與諾華諾華(Novartis)合作遞交百澤安在美國的首個新葯上市申請(BLA),用於治療既往經系統治療后的晚期或轉移性食管鱗狀細胞癌患者。
I 美國新冠死亡人數超75萬,拜登政府強制大企業員工打疫苗
美國約翰斯·霍普金斯大學的最新數據顯示,美國累計已有超75萬人死於新冠。白宮4日稱,美國勞工部下屬的職業安全與健康管理局要求全國員工人數100人或以上的僱主,確保員工在2022年1月4日前完成新冠疫苗接種,逾期未接種疫苗的員工,將需要至少每周提交一份陰性新冠檢測報告。
任何未能在1月4日之前達到要求的僱主,都可能面臨每項違規近1.4萬美元的罰款。未接種疫苗的員工將自付每周的檢測費用。

I EMA終止禮來/君實新冠中和抗體雞尾酒療法上市審查程序
11月3日,歐盟終止了關於針對Covid-19的抗體雞尾酒療法bamlanivimab+etesevimab的上市審查程序,在禮來通知該監管機構退出該藥物的審查流程,暫不尋求上市之后。
Bamlanivimab最初是由加拿大公司AbCellera開發。2020年3月12日,禮來獲得合作開發權益。Bamlanivimab2020年6月2日進入臨牀研究,是全球首個進入臨牀的新冠病毒中和抗體。
etesevimab最初由君實生物與中國科學院微生物所共同開發,去年5月,禮來以1000萬美元預付款+2.44億美元里程碑金額從君實生物獲得授權,主導大中華地區以外地區的臨牀開發。
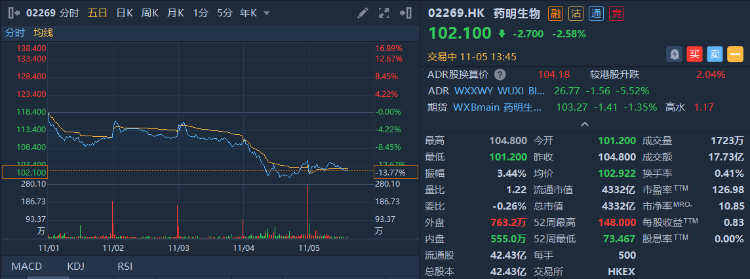
I 被傳「變相降薪」,頭部機構減倉,藥明生物本月已跌超13%
近日,藥明生物關聯公司藥明康德傳出「變相降薪」的消息,源於一份10月11日執行委員會議紀要文件。文件顯示,藥明康德為響應「共同富裕」,倡議和要求干部「主動降薪」,降薪資金將組成基金。近期CRO板塊持續下跌,市場普遍認為導火線是高瓴等頭部機構三季度減倉行業個股以及7月初CDE的抗腫瘤藥物臨牀研發新政等事件。
而招商證券表示,藥明生物於近期再次上調后的收入增速指引符合該行預測。該行維持基於貼現現金流的目標價於182港元,看好公司在生物CXO領域的領導者地位,及其強勁的增長前景,重申買入評級。
截至發稿,藥明生物本月內下跌13.76%,現報102.10港元,市值為4332億港元。
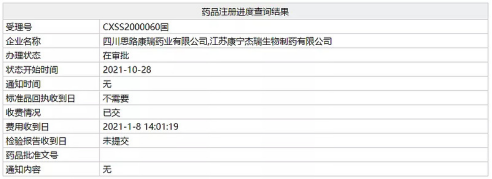
I 國內首款皮下注射 PD-L1!康寧傑瑞/思路迪「恩沃利單抗」即將獲批
11 月 4 日,NMPA 官網顯示,四川思路迪康瑞藥業的「恩沃利單抗注射液」上市申請(受理號:CXSS2000060)的審評狀態變更為「在審批」,有望在近日獲批。其適應症為:微衞星高度不穩定(MSI-H)晚期結直腸癌和 MSI-H 晚期胃癌及其 DNA 錯配修復功能缺陷(dMMR)晚期實體瘤。
患者不需要進行靜脈注射就可以輕松完成給藥過程,大大縮短了給藥時間(以秒為單位),並且具有居家自主給藥的潛力,從而更好地改善患者的生活質量。獲批上市后,恩沃利單抗將成為國產首款獲批的 PD-L1 單抗,同時也是國產首款獲批用於 MSI-H/dMMR 實體瘤的免疫療法。
I 第7項!信達生物「信迪利單抗 」新適應症申報上市
11月4日,CDE官網顯示,信達生物的信迪利單抗(商品名為:達伯舒)新適應症上市申請獲藥監局受理。根據信迪利單抗的臨牀研究進展,推測本次申報上市的適應症為聯合奧沙利帕和卡培他濱一線治療不可切除的局部晚期、複發性或轉移性胃及胃食管交界處腺癌。
信迪利單抗已在中國獲批四項適應症,分別是:
- 復發或難治性經典型霍奇金淋巴瘤;
- 聯合培美曲塞和鉑類一線治療EGFR或ALK陰性的晚期非鱗狀NSCLC;
- 聯合吉西他濱和鉑類一線治療不可手術切除的局部晚期或轉移性鱗狀NSCLC;
- 聯合貝伐珠單抗一線治療肝細胞癌。
此外,還有兩項適應症已提交上市申請,目前處於審評審批階段,分別是二線治療鱗狀NSCLC,聯合化療一線治療食管鱗癌。

I 諾和諾德公佈2021年Q3業績,銷售和利潤超出預期
諾和諾德公佈2021年Q3財務報告,報告顯示收入達356億丹麥克朗,約合55億美元,同比增長15%。利潤達121億丹麥克朗,約合19億美元,同比增長18%。
諾和諾德預計今年的銷售額和營業利潤按CER計算將增長12%至15%,這主要是受到高於預期的Ozempic市場份額增長、GLP-1市場增長和肥胖症治療銷售的推動,而營業利潤預計將在CER基礎上增長9%至12%。
I 超5000萬美元!菲吉樂科與上海醫藥達成授權合作
11月4日,菲吉樂科股份有限公司(菲吉樂科)宣佈將其金黃色葡萄球菌裂解酶體內應用的權益對外授權給上海醫藥集團股份有限公司(上海醫藥)。這項授權協議僅限於中國大陸、香港和澳門地區。
菲吉樂科是一家處於臨牀階段的專注於開發抗菌生物製劑的生物科技公司,正在開發創新的皮膚外用及系統應用的抗菌產品,后者會與合作伙伴共同開發。菲吉樂科在蒙特利爾和武漢擁有研發實驗室,蒙特利爾研發中心還擁有GMP中試設備。

風險及免責提示:以上內容僅代表作者的個人立場和觀點,不代表華盛的任何立場,華盛亦無法證實上述內容的真實性、準確性和原創性。投資者在做出任何投資決定前,應結合自身情況,考慮投資產品的風險。必要時,請諮詢專業投資顧問的意見。華盛不提供任何投資建議,對此亦不做任何承諾和保證。
推薦文章
美股機會日報 | 阿里發佈千問3.5!性能媲美Gemini 3;馬斯克稱Cybercab將於4月開始生產
港股周報 | 中國大模型「春節檔」打響!智譜周漲超138%;鉅虧超230億!美團周內重挫超10%
一周財經日曆 | 港美股迎「春節+總統日」雙假期!萬億零售巨頭沃爾瑪將發財報
一周IPO | 賺錢效應持續火熱!年內24只上市新股「0」破發;「圖模融合第一股」海致科技首日飆漲逾242%
從軟件到房地產,美國多板塊陷入AI恐慌拋售潮
Meta計劃為智能眼鏡添加人臉識別技術
危機四伏,市場卻似乎毫不在意
財報前瞻 | 英偉達Q4財報放榜在即!高盛、瑞銀預計將大超預期,兩大關鍵催化將帶來意外驚喜?

