原创精选> 正文
CDC主任点头、欧盟允许紧急使用,辉瑞能否借疫苗再创新高?
2021-12-17 20:38
作者:Jling
CDC主任同意推荐使用辉瑞疫苗!
据彭博社最新消息,美国疾病控制与预防中心(即CDC)主任Rochelle Walensky签署了CDC免疫接种实践咨询委员会投票赞成的建议。周四CDC免疫接种实践咨询委员会投票建议向成年人推荐使用Moderna公司 $MRNA 和辉瑞公司 $PFE 生产的mRNA疫苗、而非强生公司 $JNJ 的疫苗。当日美股收盘,辉瑞公司股价上涨4.17%,至61.25美元/股;过去一周涨幅达17.61%。
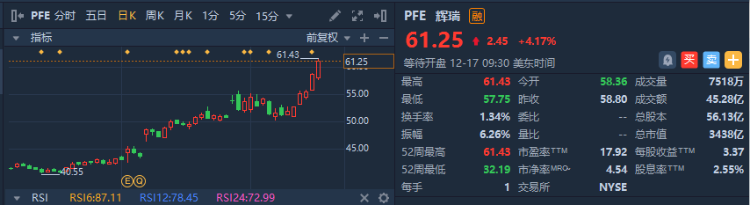
行情来源:华盛证券
据路透报道,辉瑞公司及其德国合作伙伴BioNTech SE $BNTX 周四表示他们已经向美国食品和药物管理局(FDA)申请全面批准他们的COVID-19疫苗,以包括12至15岁的青少年。该疫苗于8月在美国获得了16岁及以上人群的全面批准,最近还获得了针对5至15岁青少年的紧急使用授权。本周早些时候辉瑞发布了其COVID-19抗病毒药物即新冠口服药PAXLOVID的最新试验结果,数据再次显示未接种疫苗的高风险成年人在出现症状后三天内服用该药物,降低住院风险的概率达到89%。
看好辉瑞疫苗销售,分析师上调辉瑞目标价
Cantor Fitzgerald的分析师Louise Chen将辉瑞目标价从61美元上调至75美元,她指出,不断增加的新冠感染病例和对新变种毒株Omicron的担忧、现有新冠疫苗对Omicron的有效性减弱都能为她的观点提供支持。该分析师还将对辉瑞2027年COVID-19疫苗销售额预期从100亿美元上调到250亿美元。她预计辉瑞的COVID-19疫苗和备受期待的抗病毒药物这两项业务的销售潜力峰值将在500亿美元至600亿美元之间。
周五辉瑞周五将向投资者发表公司经营状况报告。分析师Louise Chen表示,该公司的新冠疫苗和新冠口服药Paxlovid将是被重点关注的对象。
欧洲药管局建议可紧急使用辉瑞PAXLOVID
最新消息显示,欧洲药品管理局(EMA)人用药品委员会(CHMP)发布了关于PAXLOVID™的使用建议,指出这种新冠口服药可用于治疗不需要补充氧气、病情进展风险增加的成人COVID-19患者,并建议在症状开始后5天内使用。欧盟周四裁定其成员国可以使用PAXLOVID,尽管欧盟药品监管机构尚未批准这种治疗。
辉瑞公司董事长兼首席执行官Albert Bourla表示,“CHMP的建议表明了我们在PAXLOVID治疗诊断为COVID-19的高危成人方面的数据的实力”,其还表示,“如果获得批准,PAXLOVID有可能帮助拯救生命和减少住院治疗。我们期待与EMA和全球其他监管机构合作,尽快将这种可能的治疗方法带给患者。”
风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。
推荐文章
美股机会日报 | 估值8500亿美元!传OpenAI最新融资规模将破千亿美元;黄仁勋称将发布几款世界前所未见的新芯片
美股机会日报 | 凌晨3点!美联储将公布1月货币政策会议纪要,纳指期货涨近0.5%;13F大曝光!巴菲特连续三季减持苹果
美股机会日报 | 阿里发布千问3.5!性能媲美Gemini 3;马斯克称Cybercab将于4月开始生产
港股周报 | 中国大模型“春节档”打响!智谱周涨超138%;巨亏超230亿!美团周内重挫超10%
一周财经日历 | 港美股迎“春节+总统日”双假期!万亿零售巨头沃尔玛将发财报
从软件到房地产,美国多板块陷入AI恐慌抛售潮
Meta计划为智能眼镜添加人脸识别技术
危机四伏,市场却似乎毫不在意

