原创精选> 正文
药闻头条丨FDA建议使用Moderna加强针!翰森制药本周再投siRNA
2021-10-15 13:49
I 美FDA专家组建议为65岁以上及脆弱人群提供莫德纳加强针
当地时间10月14日,美国食品和药品监督管理局(FDA)疫苗和相关生物制品咨询委员会 (VRBPAC)以19票同意、0票反对的投票结果,建议FDA授权向美国所有65岁以上人群,以及18至64岁的高风险人群使用莫德纳新冠疫苗加强针。
该新冠加强针指导方针与之前辉瑞/BioNTech的加强针方针保持一致。
Moderna此前提交了50微克加强针的授权申请,该加强针是两剂疫苗主要系列中使用的100微克剂量的一半。该公司表示,将剂量减半可以增强对冠状病毒的保护,同时有助于全球Covid-19 疫苗的供应。
来源:CNBC
I 超17.5亿美元!一周之内,翰森制药两度就siRNA疗法达成合作
10月15日,翰森制药已与Silence Therapeuticsplc订立独家许可合作协议,双方将利用后者的独家mRNAi GOLD™平台,以合作开发针对三个靶点的siRNA。根据公告,这项合作涉及金额超13亿美元。值得一提的是,就在3天前,翰森制药刚宣布与OliX Pharmaceuticals达成一项超4.5亿美元的合作,在中国发现、开发和商业化针对关键靶向适应症的siRNA疗法。
Silence Therapeutics是一家致力开发新一代药物的生物技术公司,通过利用人体天然的RNA干扰或RNAi机制来抑制特定靶基因的表达,这些靶基因被认为能在具有显著未满足的需求的疾病病理学领域中发挥作用。Silence Therapeutics的独家mRNAi GOLD™平台可用于创建siRNA,以精确靶向和肝脏中的无声疾病相关基因。
Silence Therapeutics将从翰森制药获得1600万美元的预付款,并在达到额外的开发、监管和商业里程碑后有资格获得高达13亿美元。Silence Therapeutics也将获得翰森制药产品净销售额约10%到15%区间的特许权使用费。

来源:公司公告
I 武田制药超9亿美元入局B细胞免疫疗法
10月13日,Immusoft宣布与武田制药签署了一项研究合作和许可选择权协议。武田制药将利用Immusoft的免疫系统编程ISP技术平台,发现、开发和商业化变革性细胞疗法,用于治疗罕见遗传代谢障碍。
ISP通过收集患者的免疫B细胞后进行重新编辑,并将它们分化为浆细胞,再回输到患者体内,从而实现大量持久地产生治疗性蛋白。
根据协议条款,Immusoft将获得一笔未公开的预付款和研究经费支持,并有资格获得里程碑付款,总金额可超过9亿美元。

来源:网络
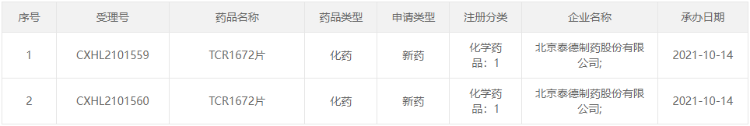
I 中美双报:中国生物制药申报 P2X3 受体拮抗剂,治疗慢性咳嗽
10 月 14 日,中国生物制药子公司北京泰德的 TCR1672 片首次在国内申报临床。这是该公司自主研发的一款二代高选择性 P2X3 受体拮抗剂,9 月 8 日刚刚向美国 FDA 递交 IND 申请并获受理。
来源:CDE官网
P2X3 受体是嘌呤类受体家族中的配体门控离子通道。TCR1672 通过阻断三磷酸腺苷 (ATP) 启动 P2X3 受体产生的钙离子内流,从而发挥对其特异性抑制作用来起到治疗效果。目前该药主要应用于临床空白的两大适应症领域,治疗呼吸领域的难治性慢性咳嗽 (RCC) 成年患者及疼痛领域的子宫内膜异位症等复杂性内脏痛患者。此外,北京泰德还在探索其在神经病理性疼痛、癌性疼痛等领域的应用。
I 抗干扰素β单抗!治疗皮肌炎辉瑞1类新药在中国获批临床
中国国家药监局药品审评中心(CDE)最新公示显示,辉瑞(Pfizer)公司申报的1类新药PF-06823859注射液获得一项临床试验默示许可,拟开发用于治疗皮肌炎。公开资料显示,PF-06823859是一种在研的抗干扰素β单克隆抗体,全球范围内已进入2期临床阶段。
PF-06823859是辉瑞开发的一种人源化干扰素β抗体,可阻断干扰素β1成纤维细胞(IFNB1),拟开发用于治疗皮肌炎和狼疮。
本次在中国,PF-06823859获批在皮肌炎中开展临床研究。皮肌炎是一种自身免疫性疾病,引起皮肤改变和肌无力。症状包括眼睑周围出现红色皮疹、关节周围出现红色肿块以及手臂和腿部肌肉无力。随着时间的推移,肌肉无力会越来越严重,并可能导致关节僵硬和肌肉萎缩。

来源:CDE官网
I 国产第2家:绿叶制药「地舒单抗」报上市
10月13日,绿叶制药宣布,其控股子公司博安生物开发的地舒单抗生物类似药(LY06006/BA6101)的上市许可申请已获得中国国家药品监督管理局药品审评中心(CDE)受理。目前,该产品在欧洲和美国的1期临床试验也在同步进行中,博安生物也计划在全球其他国家和地区开展LY06006/BA6101的注册工作。

来源:CDE官网
LY06006/BA6101是IgG2全人源单克隆抗体,为Prolia(普罗力)的生物类似药,其通过抑制RANKL与其受体RANK的结合,减少破骨细胞形成、功能和存活,从而降低骨吸收、增加骨量、改善皮质骨或松质骨强度。在全球范围内,原研产品Prolia已获批多个适应症。2020年6月,Prolia亦在中国获批上市。根据绿叶制药早前发布内容,LY06006拟开发用于:
- 治疗具有骨折高危风险的绝经后妇女骨质疏松症;
- 增加具有骨折高危风险的男性骨质疏松症患者的骨量;
- 治疗骨折高危风险的糖皮质激素诱导的男性和女性骨质疏松症;
- 增加因非转移性前列腺癌接受雄激素剥夺治疗所致的具有骨折高危风险患者的骨量;
- 以及增加因乳腺癌接受芳香化酶抑制剂治疗所致的具有骨折高危风险患者的骨量。
I 康哲药业引进的「替拉珠单抗」在中国递交上市申请
10月14日,康哲药业发布公告称,其引进的替拉珠单抗(tildrakizumab)已在中国国家药监局药品审评中心(CDE)递交新药上市申请,并获得受理。替拉珠单抗是康哲药业自Sun Pharma引进的一款创新疗法,此前已在美国获批治疗适合接受全身治疗或光疗的中度至重度斑块型银屑病成人患者。
替拉珠单抗可以选择性结合IL-23的p19亚基,并抑制其与IL-23受体作用,从而抑制促炎细胞因子和趋化因子的释放。2019年6月,康哲药业通过与Sun Pharma合作获得了替拉珠单抗在大中华地区(包括中国大陆、香港、澳门和台湾地区)开发、使用、销售、许诺销售及进口的许可权利。
此前,替拉珠单抗已在两项多中心、随机、双盲、安慰剂对照试验(reSURFACE 1和reSURFACE 2)中达到了主要疗效终点,证明与安慰剂相比,施用替拉珠单抗 100 mg能取得显著的临床改善,这一改善是通过两次用药后第12周至少75%的皮肤清除率(银屑病面积敏感指数或PASI 75)和医师全面评估(PGA)评分为“清除”或“最小”来测量的。

来源:公司公告
风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。
推荐文章
美股机会日报 | 凌晨3点!美联储将公布1月货币政策会议纪要,纳指期货涨近0.5%;13F大曝光!巴菲特连续三季减持苹果
美股机会日报 | 阿里发布千问3.5!性能媲美Gemini 3;马斯克称Cybercab将于4月开始生产
港股周报 | 中国大模型“春节档”打响!智谱周涨超138%;巨亏超230亿!美团周内重挫超10%
一周财经日历 | 港美股迎“春节+总统日”双假期!万亿零售巨头沃尔玛将发财报
从软件到房地产,美国多板块陷入AI恐慌抛售潮
Meta计划为智能眼镜添加人脸识别技术
危机四伏,市场却似乎毫不在意
财报前瞻 | 英伟达Q4财报放榜在即!高盛、瑞银预计将大超预期,两大关键催化将带来意外惊喜?

