原创精选> 正文
药闻头条丨Moderna急了!敦促FDA授权加强针,赛生新抗生素拟上市
2021-10-13 13:37
I Moderna正在敦促FDA批准其新冠半剂量加强针,但FDA拒绝给出意见
根据周二(10月12日)发布的一份简报文件,Moderna 正在敦促美国食品和药物管理局批准其 Covid-19 疫苗的半剂量加强针,该机构的疫苗顾问将召开重要会议。
该公司正在申请50微克加强针的授权——是两剂疫苗主要系列中使用的100微克剂量的一半。该公司表示,将剂量减半可以增强对冠状病毒的保护,同时有助于全球Covid-19 疫苗的供应。
同日(10月12日),美国食品药品管理局(FDA)的科学家拒绝就是否支持Moderna的新冠疫苗加强针注射给出推荐意见。
FDA专家们称,总体而言,数据显示两剂Moderna疫苗仍足以预防美国的严重新冠疾病与由此导致的死亡案例。一些有效性研究表明,随着时间推移,Moderna两剂疫苗对有症状的感染或对Delta变体毒株的疗效会下降,另一些研究则显示疗效没有下降。
FDA 的疫苗和相关生物产品咨询委员会将于本周五开会,审议Moderna和强生Covid-19疫苗的加强剂量。

来源:CNN Health
I 赛生药业新型抗生素「替拉凡星」申报上市
10月12日,国家药监局官网显示,赛生药业/Theravance注射用盐酸替拉凡星(曾用名:特拉万星)在国内申报上市。
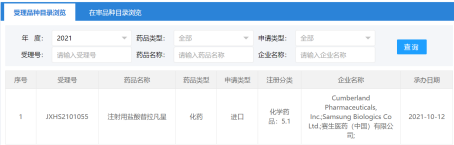
来源:国家药监局官网
替拉凡星具有双重抗菌作用机制,一方面通过与包含肽D-Ala-D-Ala的残基聚糖前体(脂质II和未交联的多聚糖链)结合,阻碍底物与转糖苷酶和转肽酶相互作用,从而干扰肽聚糖交联和聚合,抑制细菌细胞壁合成。另一方面,替拉凡星还可以直接作用于细菌的细胞膜,引起膜电位快速去极化并增加膜通透性,由此破坏细菌细胞膜的屏障功能,同时胞内大量K+和ATP外漏导致细胞死亡。
2015年5月,赛生药业与Theravance达成协议,获得在中国大陆和香港特别行政区、澳门特别行政区、台湾地区和越南独家开发和商业化Vibativ权利。

来源:Theravance官网
I 阿斯利康全球研发中国中心在上海正式开幕
阿斯利康宣布全球研发中国中心正式开幕,上海国际生命科学创新园、医疗人工智能创新中心同步正式启用。
作为全球研发网络的重要成员,阿斯利康全球研发中国中心深度参与阿斯利康的全球新药研发,从研发管线布局、研发策略制定,到全生命周期产品开发和上市,覆盖肿瘤、呼吸、免疫、心血管、肾脏、代谢、罕见病等广泛疾病领域。
2007年,阿斯利康在华投资建立中国创新中心。2013年正式设立中国新药研发部,以支持阿斯利康的创新药物在中国的临床开发和上市。2019年中国国际进口博览会期间,阿斯利康正式宣布将中国新药研发部升级为阿斯利康全球研发中国中心,并于今年正式建成和启用。

来源:网络
I 治疗慢性乙肝!歌礼制药将公布PD-L1恩沃利单抗IIa期临床结果
10月12日,歌礼制药宣布,将在2021年美国肝病研究协会年会口头报告ASC22(恩沃利单抗)慢性乙型肝炎IIa期研究结果。美国肝病研究协会年会是目前世界上最具权威的肝脏病学会议之一,本届会议将于2021年11月12日至2021年11月15日举行。
恩沃利单抗(KN035)是重组人源化PD-L1单域抗体Fc融合蛋白,由康宁杰瑞自主研发,2016年起与思路迪医药共同开发,有望成为全球首个上市的通过皮下注射给药的PD-L1抗体。KN035在安全性、便利性、依从性等方面和已上市的同类药物相比,具有显著的差异化优势,可切实改善病人生活品质。其治疗晚期实体瘤的上市申请目前处于“审评审批”阶段。
2019年1月歌礼与康宁杰瑞达成合作,获得在大中华区开发恩沃利单抗治疗乙型肝炎和其他病毒性疾病的独家许可协议。

来源:网络
I 欧康维视酪氨酸激酶抑制剂首次获批临床,治疗干眼病
10月12日,CDE官网显示,欧康维视OT202滴眼液临床试验申请首次获得药监局的批准,用于治疗干眼症。
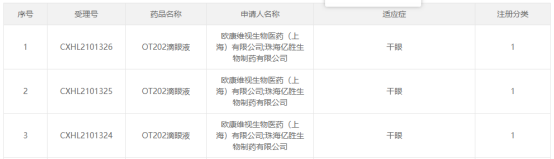
来源:CDE官网
OT202滴眼液是欧康维视自主研发的一种酪氨酸激酶抑制剂,通过抑制Syk激酶的活性达到抗炎作用,在豚鼠免疫型干眼症模型及小鼠东莨菪硷干眼症模型中均显示出显著的治疗及抗炎作用。毒理学研究亦指出其在动物体内具有良好的耐受性。
目前,欧康维视在研的干眼症药物有4款,分别是OT-202、OT-204、OT-503、OT-1301。其中OT-204是由汇恩兰德研发的一款玻璃酸钠滴眼液,欧康维视拥有中国内地权益,已完成商业化;OT-503是由Nicox研发的一款丙酸氟替卡松纳米晶体,欧康维视拥有大中华区权益,已在美国完成II期临床试验,国内尚处于临床前阶段。而OT-1301是欧康维视自主研发的一款环孢素植入剂,尚处于临床前阶段。
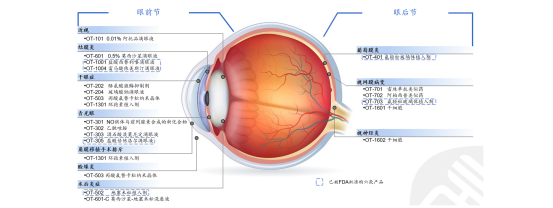
来源:官网文件
I Protagonist Therapeutics公司被告知可以继续进行血癌药物临床研究,股价盘前大涨100%
一个月前,Protagonist Therapeutics公司的股价因其血癌药物在临床前安全信号令人担忧后被FDA暂停而下跌了一半以上。
10月11日,该生物技术公司的股价在当日早上宣布恢复后,在盘前交易中已跃升近100%至35美元左右。
9月中旬,在一项动物研究显示小鼠在使用该药物时出现良性和恶性皮肤肿瘤后,FDA实施了全面临床暂停。
Protagonist公司已经在几个II期试验中测试了Rusfertide。其中包括对真性红细胞增多症(PV)的两项研究;还有一项对遗传性血色素沉着病的研究。
美国食品和药物管理局告诉这家位于加州Newark的生物技术公司,在提交了个别病人的临床安全报告后,它现在可以完全继续进行该项目。Protagonist公司还 "更新了研究者手册和病人知情同意书,对最新的安全数据库进行了全面审查,并在研究方案中纳入了新的安全和停止规则,"根据一份声明。
"我们正积极准备在2022年第一季度启动多发性血友病的3期注册研究。Protagonist将继续与美国食品和药物管理局密切合作,以确保病人的安全,并对目前和计划中的未来研究与rusfertide进行修正。
当前,该公司最新报价为31.72美元,总市值达到了15.08亿美元。
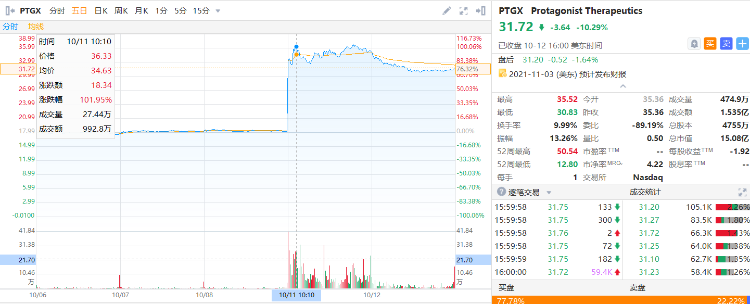
来源:华盛通
I Supernus Pharmaceuticals将花费4亿美元收购Adamas制药公司,获得两款帕金森药
10月11日,Supernus Pharmaceuticals同意以每股8.10美元的现金,或约4亿美元收购Adamas制药公司,获得两种获准用于帕金森病患者的药物。该交易还包括两项或有价值权(CVR),其总价值为每股1美元的现金,或约5000万美元。最初的现金对价比Adamas公司10月8日的收盘股价溢价约75%。
该交易将为Supernus公司提供Gocovri(金刚烷胺)缓释胶囊,该产品在美国被批准用于治疗接受左旋多巴治疗的帕金森病患者的OFF和运动障碍。Supernus还将获得Osmolex ER(金刚烷胺)缓释片的权利,该药在美国被批准用于治疗帕金森病和药物引起的成人锥体外系反应。
I Pacira BioSciences将花费4.3亿美元收购Flexion Therapeutics制药公司以获得非阿片类药物
10月12日,Pacira BioSciences宣布,达成了一项最终协议,以每股8.50美元,或约4.3亿美元,现金收购Flexion Therapeutics公司,提高其非阿片类药物的疼痛组合。该交易还包括每股价值高达8.00美元的或有价值权(CVR),它与Zilretta(曲安奈德)的销售目标和FDA对FX201和FX301的批准挂钩。
风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。
推荐文章
港股周报 | 中国大模型“春节档”打响!智谱周涨超138%;巨亏超230亿!美团周内重挫超10%
一周财经日历 | 港美股迎“春节+总统日”双假期!万亿零售巨头沃尔玛将发财报
一周IPO | 赚钱效应持续火热!年内24只上市新股“0”破发;“图模融合第一股”海致科技首日飙涨逾242%
从软件到房地产,美国多板块陷入AI恐慌抛售潮
Meta计划为智能眼镜添加人脸识别技术
危机四伏,市场却似乎毫不在意
美股机会日报 | 降息预期升温!美国1月CPI年率创去年5月来新低;净利、指引双超预期!应用材料盘前涨超10%
财报前瞻 | 英伟达Q4财报放榜在即!高盛、瑞银预计将大超预期,两大关键催化将带来意外惊喜?

