原创精选> 正文
药闻头条丨百济治疗淋巴瘤药获FDA加速批准!英国大力推广新冠加强针
2021-09-16 14:08
I 百济神州:治疗边缘区淋巴瘤「BTK抑制剂」获FDA加速批准
9月15日,百济神州宣布,泽布替尼治疗接受过至少一次抗CD20治疗的复发或难治性(R/R)边缘区淋巴瘤(MZL)成年患者的上市申请,已获美国FDA加速批准。
泽布替尼一款布鲁顿酪氨酸激酶(BTK)抑制剂。BTK全称为布鲁顿酪氨酸蛋白激酶,是B细胞表面抗原受体(BCR)信号通路的关键激酶,在B细胞生长发育、增殖分化中扮演重要角色。
当BTK异常激活的时候,B细胞便会开启“疯长”模式,形成了肿瘤。泽布替尼作为一种可与BTK共价结合的小分子化合物,通过与BTK结合来抑制其活性。

I 英国将从下周向一线医护人员以及老弱群体提供新冠疫苗加强剂
9月14日,英国政府周二表示,作为进入秋冬季节计划的一部分,将从下周开始向所有弱势群体和50岁以上的人以及一线医疗工作者提供COVID-19疫苗的加强剂量。疫苗接种和免疫联合委员会(JCVI)的建议要求在第二针之后至少六个月再接种第三针。
JCVI主席Wei Shen Lim说:"加强计划的主要目的是延长保护时间,并在我们即将进入寒冷的月份时减少严重的疾病,"他指出,大多数人也有资格接种年度流感疫苗,"我们强烈建议他们也接受这一提议。"
JCVI建议使用Pfizer/BioNTech的Comirnaty作为加强针,无论最初的免疫接种计划使用的是哪种疫苗。如果没有Comirnaty,那么可以使用半剂量的Moderna的Spikevax,而阿斯利康的Vaxzevria可以在对其他两种疫苗过敏的情况下作为加强剂使用。
据JCVI称,在英国进行的强化试验显示,Comirnaty耐受性良好,能够引发良好的免疫反应,包括针对Delta等新变种,无论前两轮接种的是哪种冠状病毒疫苗。
I Moderna称新冠疫苗免疫效果可能会减弱 支持加强针推广
Moderna总裁斯蒂芬•霍格(Stephen Hoge) 指出,与六个月相比,一年前接种疫苗的人感染新冠病毒的概率大大增加。如果采用这个数字(即每1000人中有28个病例),接种疫苗的六千万美国人,那就会有超过50万感染案例。
虽然政府和疫苗企业均希望早日推出新冠疫苗加强针,但科学家们则认为新冠加强针推广为时过早,因为联邦卫生官员引用的数据并不令人信服。在本周一,著名医学杂志《柳叶刀》发布一篇报告,该报告是由两名FDA高级官员及世界卫生组织的多位科学家共同撰写,他们认为当下向美国公众广泛分发加强注射是“不合适的”。
I Leap公布「DhKK1抑制剂」联合百济神州「PD-1抑制剂」联合疗法早期数据
近日,Leap Therapeutics宣布,其DKK1单抗DKN-01联合百济神州的替雷利珠单抗、化疗(卡培他滨 、奥沙利铂),在治疗胃癌或胃食管交界处癌 (G/GEJ) 患者的IIa期临床试验(DisTinGuish、NCT04363801)中ORR(客观缓解率)达到68.2%。
完整数据将在近期举办的ESMO大会上公布。
DKN-01是一种靶向Dickkopf-1 (DKK1) 蛋白的人源化单克隆抗体,由Leap研发。
DKK1可以调节Wnt信号通路,在多种肿瘤中高度表达,有助于维持具有免疫抑制效果的肿瘤微环境。异常的Wnt信号通常与癌症有关,促进癌细胞生长和分裂并抑制免疫系统。阻断DKK1活性,可以刺激免疫介导的抗肿瘤反应。
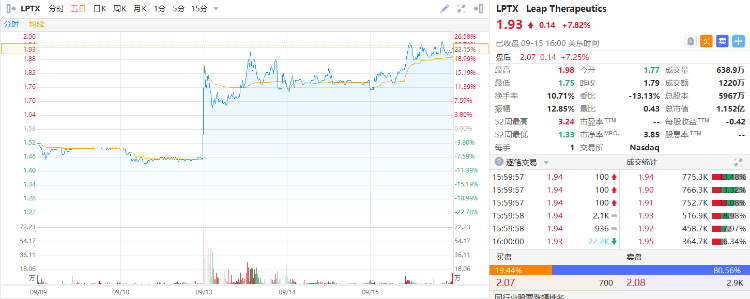
截至昨日(9月15日)美股收盘,Leap Therapeutics(LPTX)涨7.82%,报1.93美元。
来源:华盛通
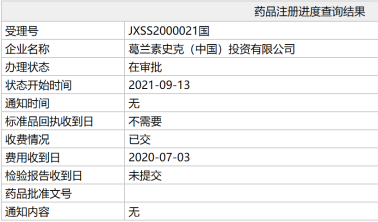
I 葛兰素史克「美泊利单抗」有望近期在中国获批上市!
中国国家药监局(NMPA)公示显示,葛兰素史克(GSK)公司的抗IL-5单抗美泊利单抗(mepolizumab)注射液的上市申请办理状态已更新为“在审批”。这意味着该药有望于近期在中国获批。
公开资料显示,美泊利单抗本次申请适用于嗜酸性肉芽肿性多血管炎(EGPA)成人患者治疗。
来源:中国国家药监局官网
I 百济神州:OX40抗体「BGB-A445注射液」临床申请获受理
近日(9月14日),百济神州BGB-A445注射液临床申请获NMPA受理。

来源:CDE官网
BGB-A445 具有较高的创新性,它与其他所有临床OX40抗体具有差异,不会阻断OX40-OX40L 结合。
关于OX40抗体:
- 若将免疫检查点抑制剂(如PD-1抑制剂)的作用比作为对免疫系统“松开刹车”,那么Anti-OX40激动型抗体则是对免疫系统“踩下油门”。
- PD-1/L1赛道已经处于非常拥挤的状况,国内各大药企开发了超过50款PD-1/L1靶点药物;而OX40靶点领域全球没有获批上市药物,国内最高研发阶段为临床一期,一片蓝海。各大医药公司都在抢占OX40 药物的首发市场。
I 基石药业-B:「PD-L1/4-1BB/HSA三抗」临床获批,治疗晚期实体瘤
9月15日,基石药业宣布,多特异性抗体CS2006(NM21-1480)在中国的临床试验申请(IND)获国家药监局的批准。
该产品极具同类最优免疫治疗骨架分子的潜力,有望成为肿瘤免疫治疗领域极有前景的下一代PD-1/PD-L1治疗方法。

I 礼来「BTK抑制剂」国内临床获批
9月15日,据CDE官网,礼来子公司Loxo Oncology药物LOXO-305片获得临床试验批准,用于治疗慢性淋巴细胞白血病(CLL)和小细胞淋巴瘤(SLL)。
LOXO-305是一款布鲁顿酪氨酸激酶(BTK)抑制剂。
BTK全称为布鲁顿酪氨酸蛋白激酶,是B细胞表面抗原受体(BCR)信号通路的关键激酶,在B细胞生长发育、增殖分化中扮演重要角色。
当BTK异常激活的时候,B细胞便会开启“疯长”模式,形成了肿瘤。LOXO-305作为一种可与BTK共价结合的小分子化合物,通过与BTK结合来抑制其活性。
与目前可用的BTK抑制剂不同的是,LOXO-305可针对当前BTK抑制剂引发的BTK C481突变,以及由于对其他细胞靶点的非靶向抑制而产生的不耐受。

风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。
推荐文章
新股暗盘 | 乐欣户外飙升超70%,中签一手账面浮盈4345港元;爱芯元智微涨超0.2%
高盛预计英伟达Q4营收达673亿美元 给出250美元目标股价
财报大跌背后:微软正在进行一场昂贵但精准的“利润置换”
港股IPO持续火热!下周6股排队上市,“A+H”占比一半
港股周报 | “AI红包大战”厮杀!腾讯周内暴跌近10%、阿里重挫8%,南下资金出手560亿港元大举抄底
美股机会日报 | 止跌企稳!纳指期货盘前涨约0.5%,有分析称美股连遭重挫后或回升;亚马逊盘前大跌超8%
一周财经日历 | 事关降息!美国1月非农、CPI数据下周公布;恒指季检结果下周五揭晓
华尔街大多头漫谈黄金“黑天鹅”风险:马斯克实现太空采金,化身全球央行行长

