原创精选> 正文
药闻头条 | 药企研发最新排名公布,百济夺第一!药明巨诺CAR-T获批上市
2021-09-03 11:17
I 500亿!319家药企研发投入曝光:9家超10亿,27家大涨超100%
日前,上市公司中期业绩报告已披露完毕,据不完全统计,319家A股及港股上市药企公布2021年H1研发投入,合计金额近500亿元。恒瑞、复星、石药、信达等多款重磅1类新药报产。
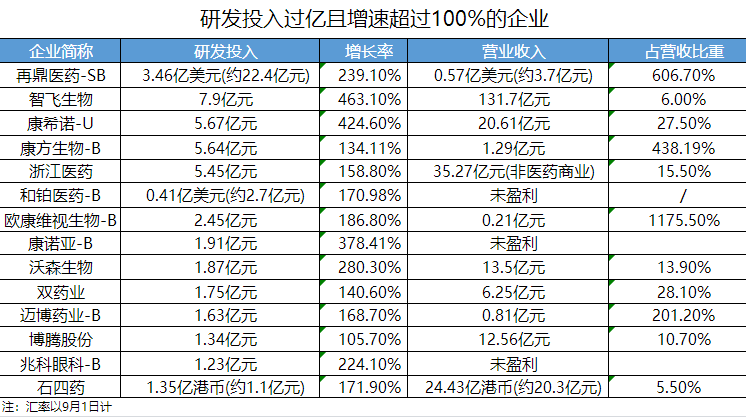
98家药企研发投入过亿,9家超10亿(去年同期5家);近8成药企研发投入呈正增长,27家暴涨超100%;创新型企业主导,9家药企研发投入占营收比重超过100%。
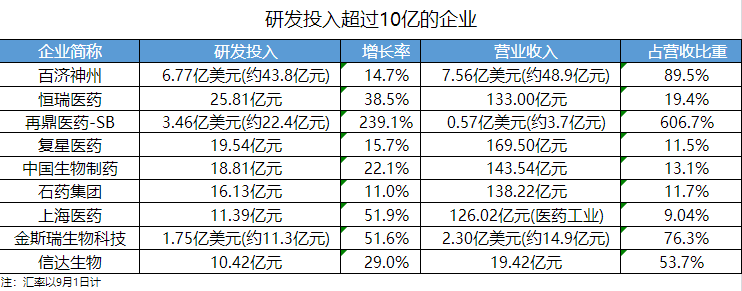
从研发强度(研发投入占营收比重)看,84家药企研发强度达10%及以上,荣昌、基石、泽璟......9家药企超过100%;18家药企暂未盈利(无产品获批进行商业销售或无产品销售产生收入),其中康方生物、神州细胞、亚盛医药的研发投入超过3亿元。
I 国内首个 1 类新药 CAR-T 产品!药明巨诺「瑞基仑赛注射液」获批上市
9 月 3 日,NMPA 官网显示,药明巨诺 CAR-T 疗法产品「瑞基仑赛注射液」(JWCAR029)获批上市,用于经过二线或以上全身性治疗后成人患者的复发或难治性大 B 细胞淋巴瘤。瑞基仑赛是国内第 2 款获批上市的 CAR-T 产品,同时值得注意的是,它也是国内首个获批的 1 类 CAR-T 、全球第 6 款获批上市的 CAR-T 产品。

瑞基仑赛注射液是美国细胞疗法公司Juno开发的一款靶向CD19的CAR-T细胞疗法。2016年4月,Juno与药明康德联合创立药明巨诺,共同在中国进行CAR-T和T细胞受体(TCR)疗法的本土化开发。
I 强生精神分裂症治疗药物Invega Hafyera获批上市
9月1日,强生宣布,美国FDA已批准其长效非典型抗精神病药物Invega Hafyera上市,用于治疗成人精神分裂症。强生表示,这是FDA批准治疗该病的首款只需每年给药2次的注射药物。
本次批准是基于一项为期12个月、随机双盲的3期临床试验结果。试验结果显示,治疗12个月期间,与活性对照组相比,Invega Hafyera在首次疾病复发所需时间的主要终点上达到非劣效性标准。92.5%的Invega Hafyera组患者在12个月中无复发,对照组为95%。
I 国产首家!华东医药利拉鲁肽注射液报上市
9 月 2 日,CDE 官网显示,华东医药递交了利拉鲁肽注射液的上市申请并获承办。这是首款报产的国产利拉鲁肽生物类似药。利拉鲁肽是糖尿病治疗的重要靶点,具有多种生理功能:血糖依赖性促进胰岛素分泌、保护胰岛 β 细胞、延迟胃排空降低食欲等。
本次华东医药的利拉鲁肽申报上市,成为了国产首家申报上市的利拉鲁肽类似药。不过,这一品种竞争激烈,还有 7 家已经进入 III 期临床,包括通化东宝、正大天晴、东阳光、珠海联邦、万邦生化等;5 家启动了 I 期临床或 BE 试验。
I 百济引进项目:Assembly 公司乙肝新药因肝脏毒性终止临床开发
9 月 1 日,Assembly Biosciences 宣布其乙肝药物 ABI-H2158 因肝毒性而终止了临床开发。这次终止是基于正在进行的 2 期临床中观察到的谷丙转氨酶(ALT)水平升高,这与药物诱导的肝毒性一致。
值得注意的是,百济神州于 2020 年 7 月以 4000 万美元首付款+至多 5 亿美元潜在开发、药政及销售里程碑付款+销售特许使用费获得了 Assembly Bio 的 3 款乙肝治疗药物在中国的独家开发和商业化权益,2158 正是其中之一。
I 靶向诺奖信号通路!默沙东1类新药在中国获批临床
9月2日,中国国家药品监督管理局药品审评中心最新公示,默沙东申报的1类新药belzutifan片获得临床试验默示许可,拟开发用于肾细胞癌(RCC)。
公开资料显示,Belzutifan(MK-6482)靶向的信号通路与缺氧诱导因子(HIF-2α)有关,该通路的相关研究曾在2019年荣获诺贝尔生理学或医学奖。同时,它也是FDA批准的首个缺氧诱导因子抑制剂。

I 赛诺菲TGF-β抗体治疗肝癌获临床试验批准
9月2日,据CDE官网,赛诺菲SAR439459注射用粉针获得临床试验批准,用于治疗肝癌。SAR439459具有减轻TME中TGF-β介导的免疫抑制,以恢复免疫检查点抑制剂敏感性的潜力。
I 全球独创!天坛生物「静注COVID-19人免疫球蛋白」获批临床
天坛生物9月2日发布公告称,该公司所属国药集团武汉血液制品有限公司 (以下简称“武汉血制”)获得国家药品监督管理局签发的《药物临床试验批件》, 同意武汉血制开展“静注COVID-19人免疫球蛋白(pH4)”临床试验。
据公告称,静注COVID-19人免疫球蛋白(pH4)是天坛生物独创产品,国内外无同类产品上市,该产品目前已投入研发2977.29万元。
风险及免责提示:以上内容仅代表作者的个人立场和观点,不代表华盛的任何立场,华盛亦无法证实上述内容的真实性、准确性和原创性。投资者在做出任何投资决定前,应结合自身情况,考虑投资产品的风险。必要时,请咨询专业投资顾问的意见。华盛不提供任何投资建议,对此亦不做任何承诺和保证。
推荐文章
美股机会日报 | 市场风格趋变?美银称接下来是小盘股的天下;金价重回5000美元上方,贵金属板块盘前齐升
新股暗盘 | 乐欣户外飙升超70%,中签一手账面浮盈4345港元;爱芯元智微涨超0.2%
高盛预计英伟达Q4营收达673亿美元 给出250美元目标股价
财报大跌背后:微软正在进行一场昂贵但精准的“利润置换”
港股IPO持续火热!下周6股排队上市,“A+H”占比一半
港股周报 | “AI红包大战”厮杀!腾讯周内暴跌近10%、阿里重挫8%,南下资金出手560亿港元大举抄底
美股机会日报 | 止跌企稳!纳指期货盘前涨约0.5%,有分析称美股连遭重挫后或回升;亚马逊盘前大跌超8%
一周财经日历 | 事关降息!美国1月非农、CPI数据下周公布;恒指季检结果下周五揭晓

