熱門資訊> 正文
新股前瞻|佈局TCE腫瘤療法千億藍海,時邁藥業能否博得市場青睞?
2025-12-09 13:05
近日,又一創新葯企正式向港交所提交上市申請。根據港交所披露,浙江時邁藥業股份有限公司-B(簡稱:時邁藥業)已遞交主板上市招股書,由華泰國際擔任獨家保薦人。在此之前,時邁藥業已於2022年成功完成3.3億元C輪融資,投后估值達到22.3億元,吸引了包括貝達藥業、貝加投資、温氏股份、杭州高新金投、浙商證券及邁百瑞等多家知名機構的參與。
公開信息顯示,時邁藥業成立於2017年,作為下一代T細胞銜接器(TCE)療法的先驅及全球領軍企業,旨在利用並引導人體免疫系統對抗癌症的下一代免疫療法,公司已開發下一代先鋒療法遮蔽型TCE,可在腫瘤中被選擇性激活,用於治療實體瘤。
時邁藥業此番衝刺資本市場,正值全球TCE賽道進入高速發展期。自2024年下半年以來,該領域交易熱度持續攀升,國際巨頭爭相加碼TCE賽道。在此背景下,作為一家專注於實體瘤TCE療法、且具備多款全球前列臨牀管線的企業,時邁藥業的上市進程亦自然備受矚目。
佈局TCE療法 四款創新葯物處於臨牀階段
智通財經APP瞭解到,時邁藥業目前仍處於臨牀研發階段,並無產品商業化。財務數據顯示,2023年、2024年及2025年上半年,公司其他收入及收益分別為1464.9萬元、661.8萬元及227.8萬元(人民幣,下同)。招股書指出,時邁藥業產生收益的金融資產為理財及結構性存款,各期末分別為2.16億元、1.64億元及6663.7萬元,其中主要是結構性存款。
同期,公司虧損及全面虧損總額分別為7494.3萬元、5989.9萬元、2542萬元,,呈現逐年收窄趨勢。相應期間,公司研發費用分別為7610.9萬元、5338.2萬元、2238.9萬元,其中員工成本是研發開支的第二大構成,2025年上半年達到259.5萬元。期末,時邁藥業擁有研發人員31人,上半年人均月薪約1.4萬元。
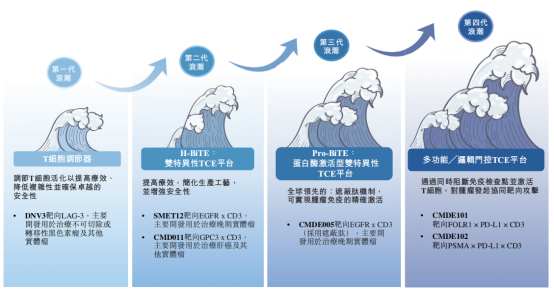
在產品管線方面,時邁藥業目前擁有四款自主研發的臨牀階段創新候選藥物,另外還有兩款處於臨牀前階段的下一代多功能╱邏輯門控TCE候選藥物CMDE101及CMDE102,它們分別是靶向FOLR1×PD-L1×CD3及PSMA×PD-L1×CD3的三特異性遮蔽型TCE。

其中,DNV3是一款靶向LAG3的潛在同類最佳T細胞調節器(TCM),也是時邁藥業進展最快的藥物,其對標的是百時美施貴寶已獲批的LAG-3抗體療法Opdualag。Opdualag於2022年獲FDA批准,成為近十年來針對全新免疫檢查點的首款腫瘤免疫療法,2024年銷售額達9.28億美元,同比增長48%,顯示出LAG-3靶點可觀的商業化潛力。
招股書顯示,臨牀前及臨牀數據表明,DNV3具有逆轉對PD-1/PD-L1抑制劑耐藥性的潛力。在小鼠研究中,DNV3對T細胞及B細胞的結合能力明顯高於現有可比療法(對T細胞高出20%,對B細胞高出十倍以上)。
此外,現有臨牀試驗結果表明,DNV3與抗PD-1抗體及化療的聯合治療於既往接受PD-(L)1抑制劑治療的18名黏膜黑色素瘤患者中取得44.4%的客觀緩解率(ORR),根據公開可得數據,高於現有可比療法約三倍;於皮膚黑色素瘤中,IIT及II期試驗數據顯示,採用相同聯合療法的12名皮膚黑色素瘤患者的客觀緩解率為66.7%,根據公開可得數據,高於現有可比療法5倍以上。
公司已於2022年3月完成DNV3單藥靶向治療晚期╱轉移性實體瘤及淋巴瘤的I期臨牀試驗,目前正開展DNV3聯合抗PD-1抗體及化療的靶向治療局部晚期不可切除或轉移性黑色素瘤的II期臨牀試驗。
根據弗若斯特沙利文的資料,截至最后實際可行日期,在治療黑色素瘤的抗LAG-3抗體候選藥物中,DNV3按臨牀開發階段計在全球及中國均排名第二。目前中國尚未有抗LAG-3抗體藥物獲批,DNV3在此領域具備明顯的先發優勢。
時邁藥業的另一款候選藥物SMET12是一款潛在同類首創靜脈注射用EGFR×CD3TCE,適應症為表皮生長因子受體(EGFR)陽性晚期實體瘤,研發進度同樣領先,在全球與中國同類候選藥物中臨牀進展排名第一。SMET12已獲得美國FDA的IND批准,目前處於IIa期臨牀試驗階段。
此外,CMD011是一款潛在同類最佳的GPC3×CD3 TCE,CMDE005是一款潛在同類首創EGFR×CD3下一代遮蔽型TCE,二者均已獲得FDA 的IND批准,並進入I期臨牀。CMD011在同類藥物中排名全球前二,CMDE005則是中國首個且全球前二進入臨牀的採用遮蔽肽技術的TCE藥物。
招股書顯示,公司的每一款候選藥物均通過專門的研發平臺開發,包括多通道抗體發現平臺、H型雙特異性TCE平臺(H-BiTE平臺)、蛋白酶激活型雙特異性TCE平臺(Pro-BiTE平臺)以及多功能╱邏輯門控TCE平臺,共同構成了公司在TCE賽道中的核心競爭壁壘。
千億美元藍海,TCE領域升溫
作為一種通過同時結合腫瘤細胞表面抗原與T細胞表面CD3分子、從而精準激活T細胞殺傷腫瘤的創新療法,TCE兼具特異性強、可及性高、安全性好等多重優勢。相比個性化、定製化的CAR-T療法,TCE擺脫了個體化製備的高成本與複雜性;相對於抗體偶聯藥物(ADC),TCE則避免了化療載荷帶來的細胞毒性風險,有望成為下一代腫瘤免疫治療的重要方向。
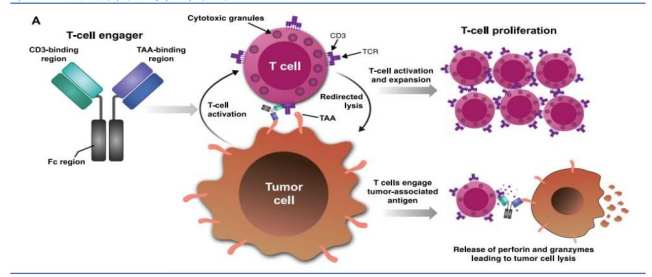
(TCE雙抗原理示意圖,圖源招商證券)
智通財經APP瞭解到,近年來全球生物醫藥領域對T細胞銜接器(T cell-engager,TCE)的關注度顯著提升,相關交易與合作持續升溫。2024年以來,全球相關交易總額已突破85億美元,安進、強生、艾伯維、默沙東、羅氏等國際巨頭紛紛入局。其中,安進的CD19×CD3雙抗Blincyto(貝林妥歐單抗)成為首個年銷售額突破10億美元的TCE藥物,2024年銷售額超過12億美元,驗證了該賽道的商業價值。
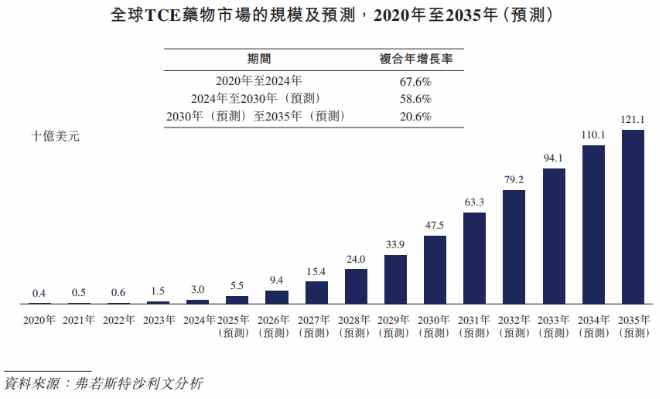
市場規模方面,全球TCE藥物市場已從2020年的4億美元快速增長至2024年的30億美元,年複合增長率達67.6%。據預測,到2030年市場規模有望升至475億美元,2035年進一步突破1,200億美元,市場增長動力強勁。
然而,TCE賽道內部呈現明顯的分化格局,各適應症領域「冷熱不均」。與CAR-T類似,TCE的發展遵循從血液瘤向實體瘤、再向自免疾病延伸的路徑。長期以來,TCE的應用主要侷限於血液瘤領域,而血液瘤僅佔癌症病例的不足10%,臨牀與市場空間相對有限;真正佔據癌症90%以上的實體瘤,因存在實體瘤TAA靶向安全性、實體瘤淋巴細胞數量較少等諸多挑戰,TCE研發進展緩慢。
2024年5月,安進的塔拉妥單抗被FDA加速批准用於治療三線小細胞肺癌,也成為首款治療實體瘤的TCE藥物,一時之間風頭無兩,使得市場對TCE實體瘤療法的關注度大增。
根據時邁藥業招股書披露,當前僅有兩款用於實體瘤的TCE藥物獲得全球批准,市場存在大量空白,這為具備相關佈局能力的創新葯企提供了結構性機遇。
以時邁藥業為例,其四款臨牀階段藥物中,除DNV3為T細胞調節器外,SMET12、CMD011及CMDE005三款均為針對實體瘤的TCE藥物,展現出明確的差異化定位。
在國內,TCE賽道參與者眾多,據不完全統計,截至2025年11月,國內在研管線已超150條,但多數仍聚焦於血液瘤且處於研發早期階段。
實體瘤領域競爭相對稀少,已有澤璟製藥、康諾亞、維立志博等企業進行佈局。其中,澤璟製藥的三抗療法ZG006在早期臨牀中展現出優於同類國際療法的緩解率,康諾亞通過多款TCE雙抗產品的對外授權實現了資產價值提前變現,維立志博則採用「血液瘤打底、實體瘤突破、自免領域卡位」的三維策略,公司的LBL-033(MUC16xCD3)是全球第二款進入臨牀階段的MUC16靶向TCE雙抗,聚焦卵巢癌、宮頸癌等婦科實體瘤,填補了實體瘤MUC16靶點治療的空白。
值得關注的是,自身免疫疾病正成為TCE療法下一個潛在的爆發點。與CAR-T相比,TCE可通過劑量調節更好控制細胞因子風暴(CRS)風險,且多數可開發爲皮下給藥,在長期用藥安全性、便捷性與患者依從性方面具備明顯優勢。
數據顯示,全球已有20余款TCE藥物開展自免相關臨牀研究,靶點組合類型主要集中在 CD3×CD19、CD3×CD20、CD3×BCMA等。2024年8月,默沙東以13億美元收購同潤生物的CD3×CD19雙抗CN201,體現出大藥企對TCE在自免領域應用前景的認可。
整體來看,在TCE賽道潛力逐漸顯現的當下,時邁藥業作為一家專注於實體瘤TCE療法的創新葯企,多款核心藥物具備「同類最佳」潛力,且研發進度處於全球前列,市場同類競爭者較少,具備可觀的長期商業化前景。
與此同時,值得注意的是,公司產品管線均處於臨牀早中期,療效與安全性有待大規模臨牀驗證;作為一家高成長、高投入的生物醫藥企業,未來數年仍需持續高強度研發投入,未來現金流及融資能力或成為挑戰。考慮到TCE賽道早期入場機遇,時邁藥業不失為一家值得關注的投資標的。
推薦文章
美股機會日報 | 估值8500億美元!傳OpenAI最新融資規模將破千億美元;黃仁勛稱將發佈幾款世界前所未見的新芯片
美股機會日報 | 凌晨3點!美聯儲將公佈1月貨幣政策會議紀要,納指期貨漲近0.5%;13F大曝光!巴菲特連續三季減持蘋果
美股機會日報 | 阿里發佈千問3.5!性能媲美Gemini 3;馬斯克稱Cybercab將於4月開始生產
港股周報 | 中國大模型「春節檔」打響!智譜周漲超138%;鉅虧超230億!美團周內重挫超10%
一周財經日曆 | 港美股迎「春節+總統日」雙假期!萬億零售巨頭沃爾瑪將發財報
從軟件到房地產,美國多板塊陷入AI恐慌拋售潮
Meta計劃為智能眼鏡添加人臉識別技術
危機四伏,市場卻似乎毫不在意

