熱門資訊> 正文
新股前瞻|全球首款幽門螺桿菌新葯臨近上市,丹諾醫藥能否成為行業黑馬?
2025-08-06 20:01
作為一種廣泛存在的消化道病原體,幽門螺桿菌在全球範圍內感染率超過50%,已成為威脅人類健康的重要公共衞生問題。流行病學調查顯示,該菌株與胃癌發病密切相關,被列為I類致癌原。在我國,幽門螺桿菌感染呈現明顯的家庭聚集性特徵,總體感染率高達70%以上,幽門螺桿菌根除治療的必要性凸顯。在這樣的背景下,相關板塊也受到市場關注。
近日,抗菌新葯研發商丹諾醫藥(蘇州)股份有限公司 - B(簡稱「丹諾醫藥」)向港交所提交上市申請書,中信證券和農銀國際為聯席保薦人。
需求持續擴大,市場前景廣闊
智通財經APP瞭解到,幽門螺桿菌是一種革蘭氏陰性微需氧病原菌,與多種胃部疾病密切相關,包括 胃潰瘍、慢性進行性胃炎及胃癌。約80%的胃癌與幽門螺桿菌有關。因此,其被世界 衞生組織列為I類致癌物。除了在胃腸道病理學中已確認的作用外,越來越多的證據表 明,幽門螺桿菌可能亦通過擾亂胃外的多種生物過程而導致多種胃外疾病。在中國的所有病原體中,其疾病發病數位居首位,超過了肺結核及乙型肝炎。
中國幽門螺桿菌的高患病率導致每年估計有340,000例新發胃癌 病例,佔全球所有與幽門螺桿菌相關的胃癌病例的42%。由於認識提高及防控工作的 影響,幽門螺桿菌感染病例數預計將略微下降,由2019年的6.233億例降至2024年的 6.211億例,並進一步降至2030年的6.072億例及2035年的5.940億例。
儘管幽門螺桿菌在中國的感染人數有所下降,但2019年至2024年,幽門螺桿菌 感染的檢出率及治療率均有所上升,預計還會持續上升。在中國,幽門螺桿菌感染在 中國的檢出率於2019年為3.0%,於2024年增至3.6%,並預計將於2035年增至5.8%。 同樣,於2019年,幽門螺桿菌感染在全球的檢出率於2019年為4.5%,於2024年增至 4.7%,並預計將於2035年增至6.3%。
在這樣的背景下,治療幽門螺桿菌感染藥物的市場規模持續擴大。於2019年,治療幽門螺桿菌感染藥物的全球市場規模為53億美元,並以6.0%的 複合年增長率增長至2024年的69億美元。隨着公眾對幽門螺桿菌感染相關健康風險的 意識日益提高,預計將於2029年進一步擴大至100億美元,2024年至2029年的複合年 增長率為7.6%。於2029年至2035年,預計該市場將以9.6%的複合年增長率持續增長, 於2035年將達到161億美元。
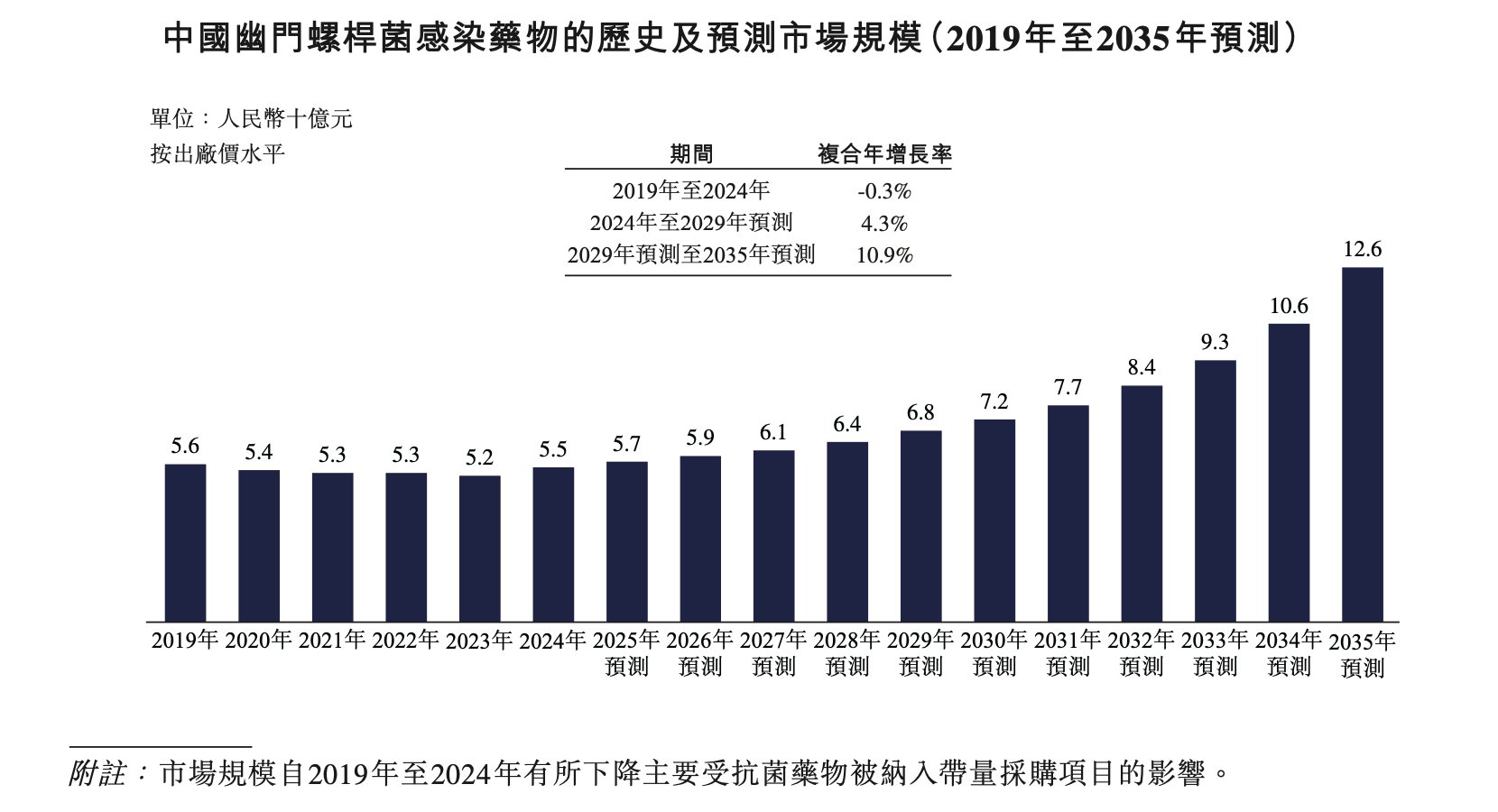
於2019年,治療幽門螺桿菌感染藥物的中國市場規模為56億元(人民幣,下同)。預計將 由2024年的55億元增至2029年的68億元,複合年增長率為4.3%。預期該 市場將繼續增長,到2035年將達到126億元,2029年至2035年的複合年增長率為10.9%。
智通財經APP瞭解到,據美國胃腸病學會(ACG)圍繞幽門螺桿菌防治2024年發佈的最新建議指出,儘管抗生素聯合療法仍是核心治療手段,但由於克拉黴素和甲硝唑等傳統抗生素耐藥率持續上升,臨牀推薦方案已從三聯療法轉向耐藥性更低的四聯療法。
值得一提的是,截至目前,全球範圍內尚未有創新型抗菌藥物獲批用於幽門螺桿菌感染。不過新葯物新療法在不斷冒頭,一些新的抗生素加益生菌等聯合療法正在實驗中,理論上來説有望在進一步降低耐藥性的同時提高治療效果。
其中,丹諾醫藥的利福特尼唑是全球唯一一款正在研發的用於治療幽門螺桿菌感染的創新型抗菌藥物,計劃於2025年8月底前提交NDA。
這意味幽門螺桿菌治療市場即將迎來新葯,那麼丹諾醫藥到底是一家怎樣的醫藥公司呢?會給相關市場帶來多大的格局變化呢?
核心產品上市在即
據招股書顯示,丹諾醫藥於2013年註冊成立,是一家臨近商業化階段的生物科技公司,專注於發現、開發及商業化差異化的創新葯產品,以解決細菌感染及細菌代謝相關疾病領域的未被滿足臨牀需求。
憑藉自主開發的多靶點偶聯分子技術,公司致力於為患者提供最佳治療方案,以克服傳統治療的侷限性並改善患者預后。截至目前,公司已建立一條由七項創新資產組成的差異化管線,包括三項核心產品:即利福特尼唑(TNP-2198),是全球首個且唯一治療幽門螺桿菌(「幽門螺桿菌」)感染的新分子實體(「NME」)候選藥物;利福喹酮(TNP-2092)注射劑,一款潛在首創三靶點治療植入體相關細菌感染的候選藥物;及TNP-2092口服制劑,全球首個用於治療腸道菌羣代謝相關疾病的多靶點候選藥物。
公司的核心產品利福特尼唑(TNP-2198)是由利福黴素藥效團和硝基咪唑藥效團構建的穩定偶聯藥物。通過抑制RNA聚合酶和硝基還原酶激活產生高活性物質實現殺菌作用,對微需氧菌和厭氧菌具有協同雙重作用機制。利用這種獨特的多靶點機制,利福特尼唑有望克服抗菌藥物耐藥性這一重要且日益嚴重的全球挑戰。作為三聯療法的一部分,與目前指南推薦的一線治療方案鉍劑四聯療法(「BQT」)相比,利福特尼唑在療效、安全性、臨牀應用和患者潛在依從性方面具有顯著優勢。
智通財經APP瞭解到,丹諾醫藥已完成利福特尼唑三聯療法(「RTT」)對比BQT的中國III期頭對頭臨牀試驗,並計劃於2025年8月底前向國家藥品監督管理局(「國家藥監局」)提交新葯上市申請(「NDA」)。臨牀試驗結果表明,RTT在根除率、安全性及耐受性方面較BQT均有優勢。值得注意的是,在多重耐藥人羣中,RTT顯示出對BQT的優效性。這項試驗的結果顯示,RTT組的臨牀相關TEAE發生率為37.3%,BQT組則為53.2%。大部分TEAE的嚴重程度為輕度至中度,且未報告與利福特尼唑相關的SAE。這些研究結果顯示,與BQT相比,RTT的安全性與耐受性較佳。此外,RTT無需提前進行藥敏試驗,這一特點凸顯其成為標準化一線療法的潛力,可實現與尿素呼氣試驗(「UBT」)的無縫銜接。此外,RTT給藥更為便捷,再加上更優的安全性和耐受性特徵,預計將顯著提高患者依從性。
而從商業化來看,丹諾醫藥正在為利福特尼唑實施明確的臨牀開發及商業化策略。通過與遠大生命科學簽訂的獨家商業合作協議,公司將藉助其強大的營銷能力和豐富的商業化資源,支持用於治療幽門螺桿菌感染的利福特尼唑在中國成功上市。憑藉美國食品藥物管理局(「FDA」)授予的IND許可、快速通道及合格抗感染產品(「QIDP」)認定,利福特尼唑可能受益於FDA的加速審評流程,有望加快在美國及其他海外市場的上市步伐。除幽門螺桿菌感染外,利福特尼唑在更廣泛的抗菌應用領域展現潛力。基於已獲得國家藥品監督管理局的IND批准,公司計劃推進利福特尼唑治療細菌性陰道病及艱難梭菌感染的臨牀開發。
不過需要注意的是,雖然公司的核心產品和關鍵產品的研發進展都在穩步推進中,但目前無穩定收入來源的丹諾醫藥已在負「重」前行。
財務方面,於2023年度、2024年度、及2025年首三個月,丹諾醫藥經營虧損分別為約1.22億元、7799.8萬元、1714.7萬元;期內虧損分別為約1.92億元、1.46億元、3801.1萬元。
此外,為不斷推進研發,近年來丹諾醫藥也耗費了不少財力和物力。報告期內,公司的研發支出分別為1.08億元、6983.8萬元及1320.5萬元。對此,公司坦言,其必須繼續分配大量人力及資本資源,以開發或獲取使公司能夠提高臨牀試驗廣度及水平的技術。公司將繼續提升其在藥物發現、開發及生產方面的技術能力,而這類工作需要大量資金及時間。這或許正是公司積極赴港IPO的意圖所在。
綜上所述,丹諾醫藥憑藉其核心產品利福特尼唑的差異化優勢和創新潛力,有望為幽門螺桿菌治療領域帶來新的突破。然而,作為尚未實現盈利的生物科技公司,其商業化進程和長期發展仍需依賴持續的研發投入和市場拓展。此次赴港上市或將為公司提供關鍵的資金支持,助力其推進管線佈局並應對未來的商業化挑戰。未來,隨着利福特尼唑的上市申請進展以及潛在市場機會的釋放,丹諾醫藥的表現值得持續關注。
推薦文章
美股機會日報 | 凌晨3點!美聯儲將公佈1月貨幣政策會議紀要,納指期貨漲近0.5%;13F大曝光!巴菲特連續三季減持蘋果
美股機會日報 | 阿里發佈千問3.5!性能媲美Gemini 3;馬斯克稱Cybercab將於4月開始生產
港股周報 | 中國大模型「春節檔」打響!智譜周漲超138%;鉅虧超230億!美團周內重挫超10%
一周財經日曆 | 港美股迎「春節+總統日」雙假期!萬億零售巨頭沃爾瑪將發財報
從軟件到房地產,美國多板塊陷入AI恐慌拋售潮
Meta計劃為智能眼鏡添加人臉識別技術
危機四伏,市場卻似乎毫不在意
財報前瞻 | 英偉達Q4財報放榜在即!高盛、瑞銀預計將大超預期,兩大關鍵催化將帶來意外驚喜?

