原創精選> 正文
藥聞頭條丨Moderna急了!敦促FDA授權加強針,賽生新抗生素擬上市
2021-10-13 13:37
I Moderna正在敦促FDA批准其新冠半劑量加強針,但FDA拒絕給出意見
根據周二(10月12日)發佈的一份簡報文件,Moderna 正在敦促美國食品和藥物管理局批准其 Covid-19 疫苗的半劑量加強針,該機構的疫苗顧問將召開重要會議。
該公司正在申請50微克加強針的授權——是兩劑疫苗主要系列中使用的100微克劑量的一半。該公司表示,將劑量減半可以增強對冠狀病毒的保護,同時有助於全球Covid-19 疫苗的供應。
同日(10月12日),美國食品藥品管理局(FDA)的科學家拒絕就是否支持Moderna的新冠疫苗加強針注射給出推薦意見。
FDA專家們稱,總體而言,數據顯示兩劑Moderna疫苗仍足以預防美國的嚴重新冠疾病與由此導致的死亡案例。一些有效性研究表明,隨着時間推移,Moderna兩劑疫苗對有症狀的感染或對Delta變體毒株的療效會下降,另一些研究則顯示療效沒有下降。
FDA 的疫苗和相關生物產品諮詢委員會將於本周五開會,審議Moderna和強生Covid-19疫苗的加強劑量。

來源:CNN Health
I 賽生藥業新型抗生素「替拉凡星」申報上市
10月12日,國家藥監局官網顯示,賽生藥業/Theravance注射用鹽酸替拉凡星(曾用名:特拉萬星)在國內申報上市。
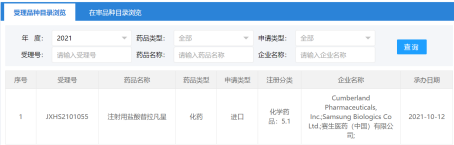
來源:國家藥監局官網
替拉凡星具有雙重抗菌作用機制,一方面通過與包含肽D-Ala-D-Ala的殘基聚糖前體(脂質II和未交聯的多聚糖鏈)結合,阻礙底物與轉糖苷酶和轉肽酶相互作用,從而干擾肽聚糖交聯和聚合,抑制細菌細胞壁合成。另一方面,替拉凡星還可以直接作用於細菌的細胞膜,引起膜電位快速去極化並增加膜通透性,由此破壞細菌細胞膜的屏障功能,同時胞內大量K+和ATP外漏導致細胞死亡。
2015年5月,賽生藥業與Theravance達成協議,獲得在中國大陸和香港特別行政區、澳門特別行政區、臺灣地區和越南獨家開發和商業化Vibativ權利。

來源:Theravance官網
I 阿斯利康全球研發中國中心在上海正式開幕
阿斯利康宣佈全球研發中國中心正式開幕,上海國際生命科學創新園、醫療人工智能創新中心同步正式啟用。
作為全球研發網絡的重要成員,阿斯利康全球研發中國中心深度參與阿斯利康的全球新葯研發,從研發管線佈局、研發策略制定,到全生命周期產品開發和上市,覆蓋腫瘤、呼吸、免疫、心血管、腎臟、代謝、罕見病等廣泛疾病領域。
2007年,阿斯利康在華投資建立中國創新中心。2013年正式設立中國新葯研發部,以支持阿斯利康的創新葯物在中國的臨牀開發和上市。2019年中國國際進口博覽會期間,阿斯利康正式宣佈將中國新葯研發部升級為阿斯利康全球研發中國中心,並於今年正式建成和啟用。

來源:網絡
I 治療慢性乙肝!歌禮制藥將公佈PD-L1恩沃利單抗IIa期臨牀結果
10月12日,歌禮制藥宣佈,將在2021年美國肝病研究協會年會口頭報告ASC22(恩沃利單抗)慢性乙型肝炎IIa期研究結果。美國肝病研究協會年會是目前世界上最具權威的肝臟病學會議之一,本屆會議將於2021年11月12日至2021年11月15日舉行。
恩沃利單抗(KN035)是重組人源化PD-L1單域抗體Fc融合蛋白,由康寧傑瑞自主研發,2016年起與思路迪醫藥共同開發,有望成為全球首個上市的通過皮下注射給藥的PD-L1抗體。KN035在安全性、便利性、依從性等方面和已上市的同類藥物相比,具有顯著的差異化優勢,可切實改善病人生活品質。其治療晚期實體瘤的上市申請目前處於「審評審批」階段。
2019年1月歌禮與康寧傑瑞達成合作,獲得在大中華區開發恩沃利單抗治療乙型肝炎和其他病毒性疾病的獨家許可協議。

來源:網絡
I 歐康維視酪氨酸激酶抑制劑首次獲批臨牀,治療乾眼病
10月12日,CDE官網顯示,歐康維視OT202滴眼液臨牀試驗申請首次獲得藥監局的批准,用於治療乾眼症。
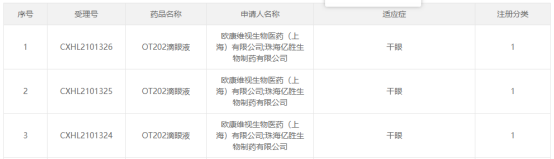
來源:CDE官網
OT202滴眼液是歐康維視自主研發的一種酪氨酸激酶抑制劑,通過抑制Syk激酶的活性達到抗炎作用,在豚鼠免疫型乾眼症模型及小鼠東莨菪礆乾眼症模型中均顯示出顯著的治療及抗炎作用。毒理學研究亦指出其在動物體內具有良好的耐受性。
目前,歐康維視在研的乾眼症藥物有4款,分別是OT-202、OT-204、OT-503、OT-1301。其中OT-204是由匯恩蘭德研發的一款玻璃酸鈉滴眼液,歐康維視擁有中國內地權益,已完成商業化;OT-503是由Nicox研發的一款丙酸氟替卡松納米晶體,歐康維視擁有大中華區權益,已在美國完成II期臨牀試驗,國內尚處於臨牀前階段。而OT-1301是歐康維視自主研發的一款環孢素植入劑,尚處於臨牀前階段。
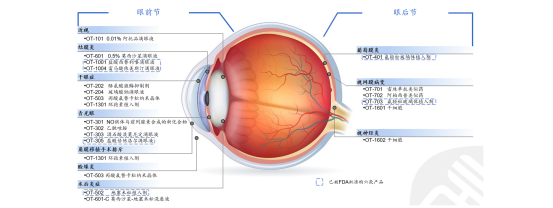
來源:官網文件
I Protagonist Therapeutics公司被告知可以繼續進行血癌藥物臨牀研究,股價盤前大漲100%
一個月前,Protagonist Therapeutics公司的股價因其血癌藥物在臨牀前安全信號令人擔憂后被FDA暫停而下跌了一半以上。
10月11日,該生物技術公司的股價在當日早上宣佈恢復后,在盤前交易中已躍升近100%至35美元左右。
9月中旬,在一項動物研究顯示小鼠在使用該藥物時出現良性和惡性皮膚腫瘤后,FDA實施了全面臨牀暫停。
Protagonist公司已經在幾個II期試驗中測試了Rusfertide。其中包括對真性紅細胞增多症(PV)的兩項研究;還有一項對遺傳性血色素沉着病的研究。
美國食品和藥物管理局告訴這家位於加州Newark的生物技術公司,在提交了個別病人的臨牀安全報告后,它現在可以完全繼續進行該項目。Protagonist公司還 "更新了研究者手冊和病人知情同意書,對最新的安全數據庫進行了全面審查,並在研究方案中納入了新的安全和停止規則,"根據一份聲明。
"我們正積極準備在2022年第一季度啟動多發性血友病的3期註冊研究。Protagonist將繼續與美國食品和藥物管理局密切合作,以確保病人的安全,並對目前和計劃中的未來研究與rusfertide進行修正。
當前,該公司最新報價為31.72美元,總市值達到了15.08億美元。
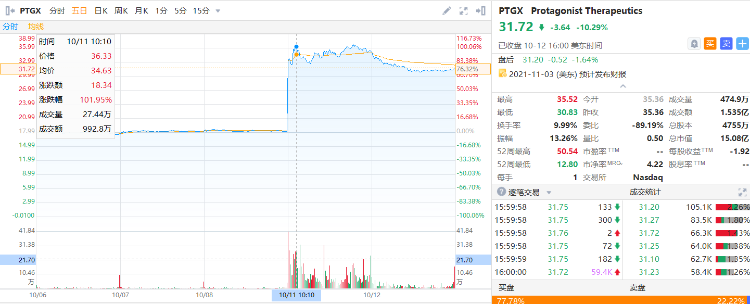
來源:華盛通
I Supernus Pharmaceuticals將花費4億美元收購Adamas製藥公司,獲得兩款帕金森藥
10月11日,Supernus Pharmaceuticals同意以每股8.10美元的現金,或約4億美元收購Adamas製藥公司,獲得兩種獲准用於帕金森病患者的藥物。該交易還包括兩項或有價值權(CVR),其總價值為每股1美元的現金,或約5000萬美元。最初的現金對價比Adamas公司10月8日的收盤股價溢價約75%。
該交易將為Supernus公司提供Gocovri(金剛烷胺)緩釋膠囊,該產品在美國被批准用於治療接受左旋多巴治療的帕金森病患者的OFF和運動障礙。Supernus還將獲得Osmolex ER(金剛烷胺)緩釋片的權利,該藥在美國被批准用於治療帕金森病和藥物引起的成人錐體外系反應。
I Pacira BioSciences將花費4.3億美元收購Flexion Therapeutics製藥公司以獲得非阿片類藥物
10月12日,Pacira BioSciences宣佈,達成了一項最終協議,以每股8.50美元,或約4.3億美元,現金收購Flexion Therapeutics公司,提高其非阿片類藥物的疼痛組合。該交易還包括每股價值高達8.00美元的或有價值權(CVR),它與Zilretta(曲安奈德)的銷售目標和FDA對FX201和FX301的批准掛鉤。
風險及免責提示:以上內容僅代表作者的個人立場和觀點,不代表華盛的任何立場,華盛亦無法證實上述內容的真實性、準確性和原創性。投資者在做出任何投資決定前,應結合自身情況,考慮投資產品的風險。必要時,請諮詢專業投資顧問的意見。華盛不提供任何投資建議,對此亦不做任何承諾和保證。
推薦文章
美股機會日報 | 凌晨3點!美聯儲將公佈1月貨幣政策會議紀要,納指期貨漲近0.5%;13F大曝光!巴菲特連續三季減持蘋果
美股機會日報 | 阿里發佈千問3.5!性能媲美Gemini 3;馬斯克稱Cybercab將於4月開始生產
港股周報 | 中國大模型「春節檔」打響!智譜周漲超138%;鉅虧超230億!美團周內重挫超10%
一周財經日曆 | 港美股迎「春節+總統日」雙假期!萬億零售巨頭沃爾瑪將發財報
從軟件到房地產,美國多板塊陷入AI恐慌拋售潮
Meta計劃為智能眼鏡添加人臉識別技術
危機四伏,市場卻似乎毫不在意
財報前瞻 | 英偉達Q4財報放榜在即!高盛、瑞銀預計將大超預期,兩大關鍵催化將帶來意外驚喜?

