热门资讯> 正文
MannKind宣布FDA批准更新Afrezza®标签 提供从多次每日注射(MDI)或胰岛素泵餐时治疗转换时的起始剂量指导
2026-01-26 11:05
- 根据成人临床试验结果更新的初始转换表显示,餐时血糖波动显著改善
康涅狄格州丹伯里和加利福尼亚州西湖村,2026 年 1 月 26 日(GLOBE NEWSWIRE)—— MannKind 公司(纳斯达克股票代码:MNKD)是一家生物制药公司,致力于通过创新、以患者为中心的解决方案来改变心血管代谢疾病和罕见肺病的慢性病护理。该公司今天宣布,美国食品药品监督管理局 (FDA) 已批准更新Afrezza® (人胰岛素)吸入粉剂的处方信息,修订了患者从皮下注射餐时胰岛素方案转换到吸入粉剂时起始餐时剂量的建议。
“我们预计此次标签更新将有助于医疗保健提供者,在患者从皮下注射餐时胰岛素过渡到吸入胰岛素(无论是注射还是胰岛素泵)时,提供更清晰的起始剂量指导,”MannKind公司糖尿病治疗领域高级副总裁兼负责人Kevin Kaiserman博士表示。“我们相信,此次标签的改进有助于支持合理启动治疗,同时巩固Afrezza已确立的临床疗效。”
更新后的标签得到了剂量优化研究(见图)和INHALE-3试验的建模数据和体内结果的支持,这些结果表明,使用现已批准的转换剂量转换为吸入式胰岛素后,餐后血糖结果得到改善。
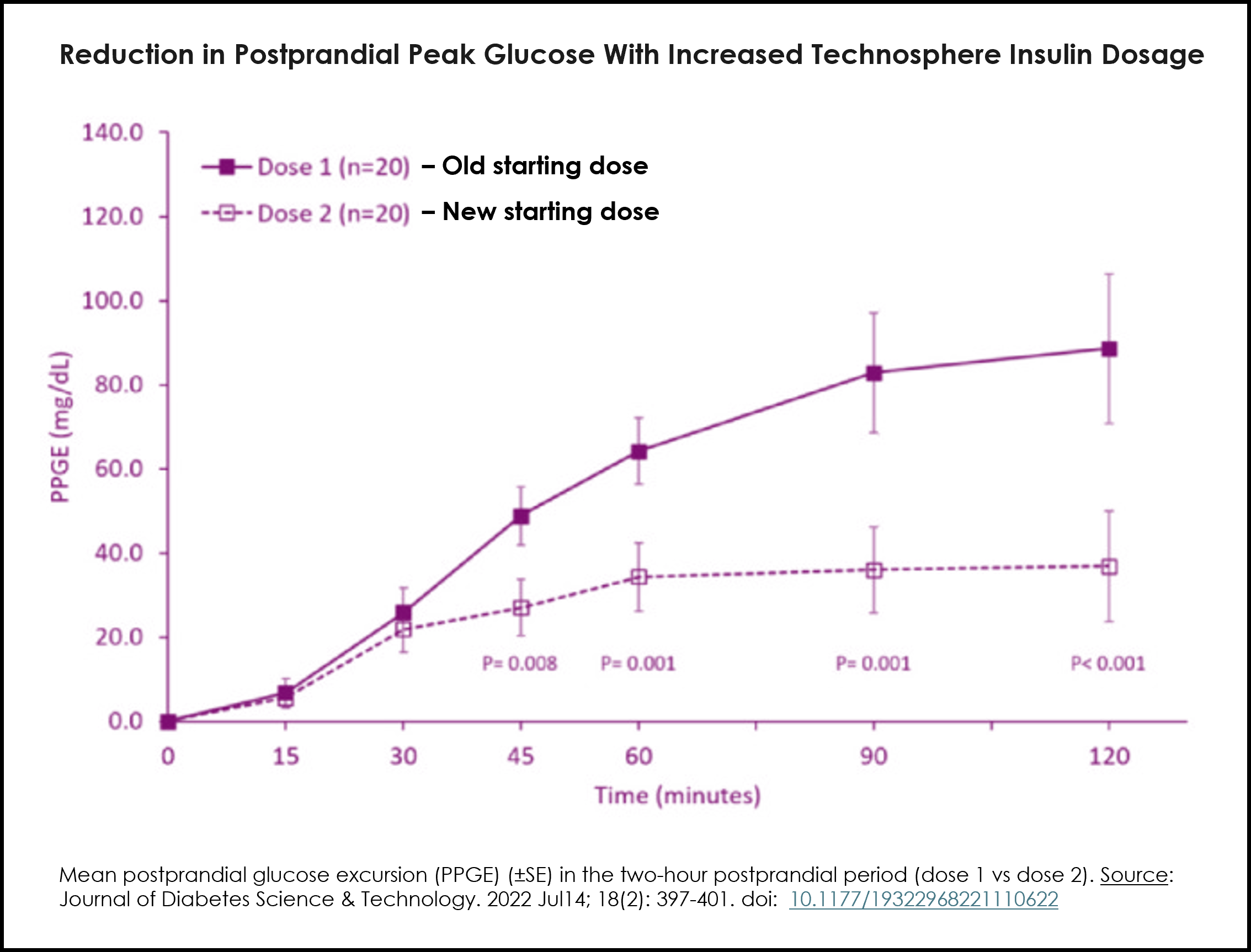
下表提供的修订剂量建议包括从餐前注射胰岛素或胰岛素泵追加剂量到阿弗瑞扎(Afrezza)相应餐前剂量的推荐剂量转换,旨在帮助成年患者在开始使用阿弗瑞扎时实现临床上适当且安全的过渡。更多详情请参阅完整处方信息。
表1:从其他餐时胰岛素方案转换至Afrezza时推荐的起始餐时剂量
| 当前皮下注射餐时胰岛素剂量 | AFREZZA 的起始剂量 |
| 最多 3 个单元 | 4个单位 |
| 4至5个单位 | 8个单位 |
| 6至7个单位 | 12个单位 |
| 8 个或更多单元 | 16个单位 |
关于阿弗雷扎
Afrezza® (发音为 uh-frezz-uh)吸入粉剂是唯一获得美国食品药品监督管理局 (FDA) 批准的超速效吸入胰岛素,用于改善成人糖尿病患者的血糖控制。Afrezza 使用小型便携式吸入器在餐前给药,通过 MannKind 的专利Technosphere®技术输送胰岛素,使其能够通过肺部超快速吸收。Afrezza 起效迅速,作用持续时间短,更接近人体对餐后的自然胰岛素反应。
指示和重要安全信息及警告
Afrezza(人胰岛素)吸入粉是一种速效吸入式人胰岛素,适用于改善糖尿病成人患者的血糖控制。
使用限制:不建议用于治疗糖尿病酮症酸中毒,也不建议用于吸烟者或近期戒烟者。
警告:慢性肺病患者有发生急性支气管痉挛的风险
- 在接受 Afrezza 治疗的哮喘和慢性阻塞性肺病 (COPD) 患者中观察到了急性支气管痉挛。
- Afrezza禁用于患有慢性肺部疾病(例如哮喘或慢性阻塞性肺病)的患者。
- 在开始使用 Afrezza 之前,应对所有患者进行详细的病史询问、体格检查和肺活量测定( FEV1 ),以确定是否存在潜在的肺部疾病。
以下情况禁用Afrezza:低血糖发作期间;患有慢性肺部疾病(如哮喘或慢性阻塞性肺病)的患者,因为存在急性支气管痉挛的风险;以及既往对常规人胰岛素产品或Afrezza中任何非活性成分有严重过敏反应的患者。使用Afrezza可能发生严重的、危及生命的全身性过敏反应,包括过敏性休克。
一项针对哮喘患者的研究显示,在接受Afrezza治疗后,由于需要评估病情,部分患者暂时停用了支气管扩张剂,随后出现了支气管收缩和喘息。开始治疗前,应通过病史询问、体格检查和肺功能测定( FEV1 )评估所有患者,以确定是否存在潜在的肺部疾病。患有慢性肺部疾病(如哮喘或慢性阻塞性肺病)的患者禁用。
胰岛素治疗方案的改变(例如,胰岛素浓度、生产商、注射部位或类型,或给药方法)可能会影响血糖控制,并增加低血糖或高血糖的风险。如有临床指征,应在严密的医疗监护下,增加血糖监测频率,对患者的胰岛素治疗方案进行必要的调整。对于2型糖尿病患者,可能需要调整同时服用的口服降糖药的剂量。
低血糖是胰岛素(包括阿弗瑞扎)最常见的不良反应。严重低血糖可导致癫痫发作,危及生命,甚至死亡。低血糖会损害注意力集中能力和反应时间,在需要这些能力的场合(例如驾驶或操作其他机械)可能会使患者本人和他人面临风险。低血糖可能突然发生,症状因人而异,即使是同一患者,症状也可能随时间变化。建议患者识别并处理低血糖,并进行自我血糖监测。对于低血糖风险较高的患者以及对低血糖症状感知能力较弱的患者,建议增加血糖监测频率。
随着时间的推移,Afrezza 会导致肺功能下降,以FEV1衡量。在排除慢性肺病患者且持续时间长达 2 年的临床试验中,Afrezza 治疗组患者的FEV1下降幅度虽小(40 mL),但高于对照组患者。即使没有肺部症状,也应在基线、治疗开始后的前 6 个月以及之后每年进行肺功能检查(肺活量测定)。如果患者的FEV1较基线下降 ≥20%,应考虑停用 Afrezza。对于出现肺部症状(例如喘息、支气管痉挛、呼吸困难或持续性或复发性咳嗽)的患者,应考虑更频繁地进行肺功能评估。如果症状持续存在,则应停用 Afrezza。
在临床试验中,接受 Afrezza 治疗的患者中观察到 2 例肺癌病例,而对照组未报告病例。在这两例病例中,既往大量吸烟史均被确定为肺癌的危险因素。试验结束后,在接受 Afrezza 治疗的非吸烟者中又报告了 2 例肺癌病例(鳞状细胞癌和肺母细胞瘤)。这些数据不足以确定 Afrezza 是否对肺部或呼吸道肿瘤有影响。对于活动性肺癌患者、既往肺癌病史患者或有肺癌风险的患者,应权衡使用 Afrezza 的益处是否大于潜在风险。
在纳入1型糖尿病患者的临床试验中,接受Afrezza治疗的患者发生糖尿病酮症酸中毒(DKA)的比例(0.43%;n=13)高于接受对照药物治疗的患者(0.14%;n=3)。1型糖尿病患者应始终将Afrezza与基础胰岛素联合使用。对于有DKA风险的患者,例如患有急性疾病或感染的患者,应增加血糖监测频率,并考虑停用Afrezza,改用其他给药途径给予胰岛素。
使用胰岛素产品可能发生严重的、危及生命的全身性过敏反应,包括过敏性休克。如果出现过敏反应,应立即停用阿弗瑞扎(Afrezza),按照标准治疗方案进行治疗,并密切监测直至症状和体征消退。
所有胰岛素产品,包括阿弗瑞扎(Afrezza),都会导致钾离子从细胞外液转移至细胞内液,可能导致低钾血症。未经治疗的低钾血症可能导致呼吸麻痹、室性心律失常甚至死亡。应密切监测有低钾血症风险患者的血钾水平,并在必要时进行治疗。
噻唑烷二酮类药物(TZDs)是过氧化物酶体增殖物激活受体(PPAR)-γ激动剂,可引起剂量相关的体液潴留,尤其是在与胰岛素联合使用时。体液潴留可能导致或加重心力衰竭。应密切观察这些患者的心力衰竭体征和症状。如果出现心力衰竭,应按照现行治疗标准进行处理,并考虑停用或减少TZDs的剂量。
最常见的不良反应是低血糖、咳嗽和喉咙痛或刺激。
请参阅Afrezza.com/safety上提供的其他重要安全信息、完整处方信息(包括黑框警告)。
关于人类
MannKind Corporation(纳斯达克股票代码:MNKD)是一家生物制药公司,致力于通过以患者为中心的创新解决方案,革新慢性病治疗。我们专注于心血管代谢疾病和罕见肺部疾病,开发并商业化治疗方案,以满足包括糖尿病、肺动脉高压、心力衰竭和慢性肾病中的体液潴留等在内的重大未满足医疗需求。
MannKind 拥有深厚的药物器械组合技术,致力于提供能够无缝融入日常生活的疗法。
了解更多信息,请访问mannkindcorp.com 。
前瞻性声明
本新闻稿中非历史事实的陈述均为前瞻性陈述,涉及风险和不确定性。这些陈述包括但不限于有关启动胰岛素治疗的更明确指导的陈述。“相信”、“预期”、“计划”、“期望”、“打算”、“将”、“目标”、“潜在”等词语及类似表达旨在识别前瞻性陈述。这些前瞻性陈述基于MannKind目前的预期。由于各种风险和不确定性,实际结果和事件发生的时间可能与此类前瞻性陈述中预期的结果和时间存在重大差异,这些风险和不确定性包括但不限于与产品候选药物的开发和商业化相关的风险,以及MannKind向美国证券交易委员会(“SEC”)提交的文件中详述的其他风险,包括其最新提交的10-Q季度报告“风险因素”标题下的风险。请勿过分依赖这些前瞻性陈述,这些陈述仅代表截至本新闻稿发布之日的信息。所有前瞻性陈述均受本警示性声明的完整约束,MannKind 不承担任何义务在本新闻稿发布之日后对任何前瞻性陈述进行修订或更新,以反映事件或情况。
AFREZZA、MANNKIND 和 TECHNOSPHERE 是 MannKind 公司的注册商标。
本公告附带的照片可在以下网址查看:https://www.globenewswire.com/NewsRoom/AttachmentNg/9c8efef3-3fac-4191-b791-45429abb7399
联系方式:MannKind 联系方式: 媒体关系: 克里斯蒂·伊阿坎杰洛 (818)292-3500 media@mnkd.com 投资者关系: 凯特·米兰达 (781)301-6869 ir@mnkd.com
推荐文章
美股机会日报 | 科技巨头迎利好?特朗普政府拟结构性豁免芯片关税;台积电1月销售额创历史新高,盘前股价涨近3%
一图看懂 | 净利大增60.7%!中芯国际Q4营收24.9亿美元,同比增长12.8%
美股机会日报 | 市场风格趋变?美银称接下来是小盘股的天下;金价重回5000美元上方,贵金属板块盘前齐升
新股暗盘 | 乐欣户外飙升超70%,中签一手账面浮盈4345港元;爱芯元智微涨超0.2%
高盛预计英伟达Q4营收达673亿美元 给出250美元目标股价
财报大跌背后:微软正在进行一场昂贵但精准的“利润置换”
港股IPO持续火热!下周6股排队上市,“A+H”占比一半
港股周报 | “AI红包大战”厮杀!腾讯周内暴跌近10%、阿里重挫8%,南下资金出手560亿港元大举抄底

